当前,双抗赛道的热度和活跃度快速上升,已经成为全球创新药行业的新热点,跨国药企们纷纷“扫货”,积极寻觅并投资有潜力的双抗管线。
根据格隆汇统计,2024年前三个季度,全球药企在双抗药物领域的交易活动异常活跃,共达成31笔交易。这一数字超过了过去三年中任何一年的全年交易量,足以显示出双抗药物在全球医药市场中的地位和影响力正在迅速上升。
其中,仅11月就发生了5起关于双抗/三抗药物的大额BD交易,高额的合作金额充分揭示了双抗赛道的巨大商业价值。
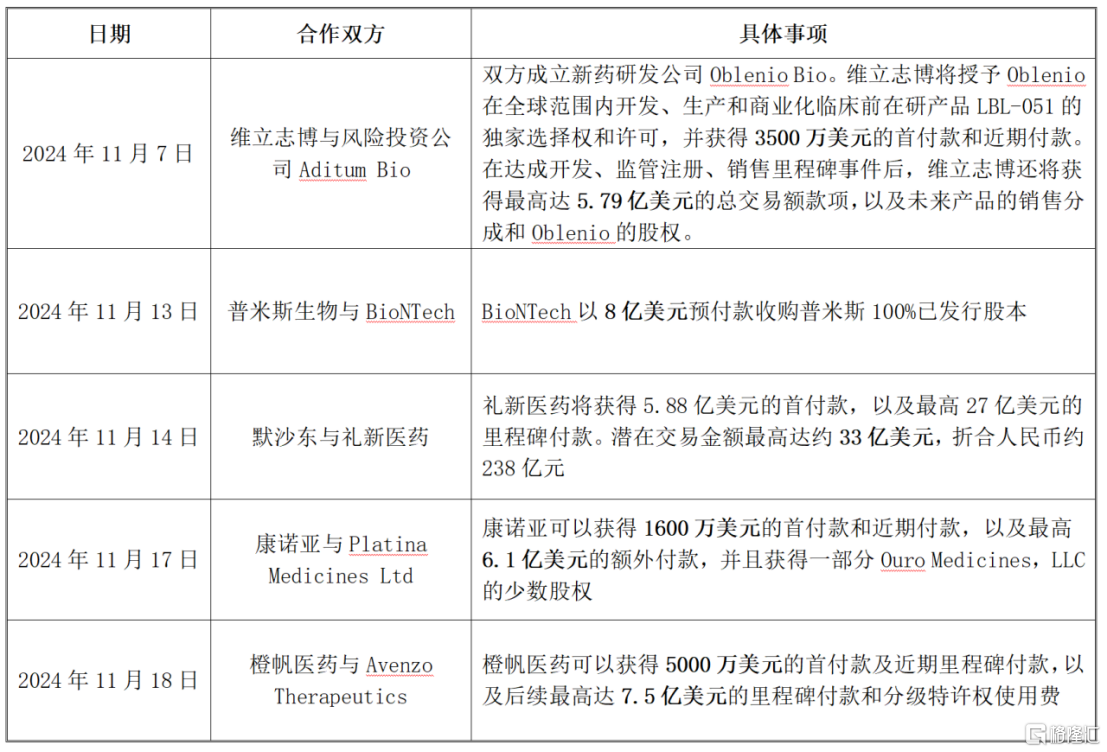
资料来源:格隆汇根据网络公开信息整理
为什么资本和全球各大药企如此青睐双抗药物?
从肿瘤免疫疗法的发展历程来看,虽然以PD-1单抗为代表的上一代肿瘤免疫疗法能够取得约20%的客观缓解率,但由于肿瘤微环境的复杂性和变异性,其疗效普遍有限,且无法持久。
由此,以双抗为代表的下一代肿瘤免疫疗法出现,展现出更高的治疗潜力。在这一阶段,免疫检查点抑制剂开始与化疗或抗血管生成药物联合使用,显著将客观缓解率提升至40%至50%。并且现如今,为了达到更高的客观缓解率,4-1BB和PD-L1组合、LAG3与PD-1联合靶向等具有新靶点且前景广阔的联合疗法出现,能够系统性靶向多种免疫途径,全面激活免疫系统,以实现最大化的抗肿瘤效果,引领着肿瘤免疫疗法的未来方向。据弗若斯特沙利文数据统计,免疫疗法有望于2030年占据全球肿瘤治疗市场的近一半市场份额。
当然,这种商业价值的体现,也反映在市场规模的增长上。药智网数据显示,2023年全球双抗药物市场规模已达88亿美元,同比增长50%,进一步证实了双抗药物市场的潜力和活力。
在这样的市场环境下,投资者对于双抗领域的关注度也随之提高,其中不乏蕴藏着一些值得关注的投资机会。
近日,维立志博递表港交所,或是一个值得观察的案例。
在目前双抗赛道高热度的背景下,根据弗若斯特沙利文的资料,维立志博的四大核心及主要产品(双抗LBL-024、LBL-034、LBL-033以及单抗LBL-007)不仅在产品设计上展现出创新性,而且临床研究进度不论于其各自药物类别或就相同靶点均也处于全球领先水平。管线布局的创新性和前瞻性,使其已经成为下一代肿瘤免疫治疗开发的领跑者。
可以说,维立志博递表港交所的时机也是恰逢其时,在为公司本身带来资本市场关注的同时,也为投资者把握这一高增长赛道提供了一个窗口。
探索差异化靶点,全球FIC/BIC彰显创新硬实力
在全球创新药研发领域,一家公司要想站稳脚跟,手里的牌必须得过硬——也就要看到产品的创新性以及临床应用潜力。
自成立以来,维立志博致力于满足中国及全球在肿瘤、自身免疫性疾病及其他重大疾病方面未被满足的医疗需求,凭借着差异化创新和广泛的治疗领域覆盖,在双抗、单抗以及ADC等多种药物领域均有布局,而且都拥有全球商业权利,提前铺垫出一条多元增长路径。
目前,公司已经建立起一条拥有12款候选药物的产品管线,包括针对肿瘤的3款单抗、4款双抗、2款ADC和1款双特异性融合蛋白,以及针对自身免疫性疾病的1款双特异性融合蛋白及1款三特异性抗体。其中6款产品已进入临床阶段,包括核心产品LBL-024以及主要产品LBL-034、LBL-033、LBL-007,且研发进展都处于全球领先水平,彰显出其在创新药研发领域的强劲实力。


资料来源:维立志博招股书
例如,在双抗领域,维立志博的核心产品LBL-024是一种关键性临床阶段的新型PD-L1与4-1BB双抗,有望成为全球首款靶向4-1BB的免疫疗法。
全球第一波以PD-1/PD-L1免疫检查点抑制剂为代表的肿瘤免疫疗法,其单药治疗也只实现20%的客观缓解率。LBL-024正是通过双靶向策略,利用这两种通路的协同效应,实现强大的疗效及可控的毒性之间的平衡,提供了更加安全且有效的治疗方案,是PD-1/L1免疫治疗的理想补充。
这里值得注意的是,4-1BB作为共刺激激动剂,单抗开发之路充满重大挑战,尤其是安全性问题。从临床数据上来看,LBL-024无论是单药还是与化疗联用,都显示出良好的安全性。在已完成的单药疗法I/II试验中,175名患者(II期111名患者)接受0.2mg/ kg至25mg/kg每三周一次的大剂量给药治疗,未观察到或达到剂量限制性毒性。绝大多数不良事件为1级或2级且可控制。而与化疗联用的Ib/II期试验中,截至2024年9月30日,在入组接受剂量6mg/kg、10mg/kg及15mg/kg的47名一线肺外神经内分泌癌患者中,亦未观察到剂量限制性毒性,且剂量达到15mg/kg时未达到最大耐受剂量。
除此以外,在单药治疗观察到的疗效数据一样令人鼓舞,截至2024年9月30日,在45名二线╱三线以上肺外神经内分泌癌的可评估患者中,有15名达到了部分缓解,8名达到了疾病稳定,即客观缓解率为33.3%及疾病控制疾率为51.1%。针对肺外神经内分泌癌,公司已启动单臂关键性临床试验。
同时,4-1BB及PD-L1的广泛表达使其在多个适应症中具有成药潜力,其应用范围广泛,可扩展到多种实体瘤。此前弗若斯特沙利文数据显示,4-1BB抗体主要的适应症病例总数呈现逐年上升态势,从2016年的971.7万例增至2020年的1063.4万例。
目前,维立志博正在进行LBL-024针对治疗晚期肺外神经内分泌癌、小细胞肺癌、胆道癌、非小细胞肺癌及其他实体瘤疗效的临床研究,并计划将进一步拓展至食管鳞状细胞癌、胃癌及肝细胞癌等更多癌症适应症领域。
短短不到三年时间,LBL-024就从首次人体实验进入针对肺外神经内分泌癌的单臂关键性临床试验,展现出良好的疗效性和安全性,是全球达到关键性临床试验阶段的首款4-1BB靶向候选药物,有望成为该适应症的首款获批药物。据悉,LBL-024已获NMPA授予治疗后线肺外神经内分泌癌的突破性疗法认定,并获得美国FDA授予的治疗神经内分泌癌的孤儿药认定。
另一款主要产品LBL-034,则是一款全球临床进度第二领先的靶向GPRC5D及CD3 T-cell engager。
从最新临床进展来看,LBL-034已经取得NMPA及美国FDA的IND批准,正在中国进行针对治疗复发性╱难治性多发性骨髓瘤的I/II期试验。
数据显示,截至2024年11月22日,在400μg/kg剂量的治疗中,LBL-034的客观缓解率(ORR)达到88.9%,达到VGPR(高质量缓解)或更好疗效比例为66.7%,以及在800μg/kg剂量中ORR达100.0%;相较于全球唯一获批GPRC5D/CD3双抗——强生公司TALVEY®(塔奎妥单抗)的公开临床数据显示,于剂量为800μg/kg的多发性骨髓瘤患者中,达到VGPR(高质量缓解)或更好疗效的比例为52%。LBL-034展现出更优疗效。这一结果不仅证明了LBL-034的潜力,也为未来的市场竞争奠定基础。根据强生的销售额预测,TALVEY®的全球年销售峰值将达到50亿美元。
由此不难判断,若后续LBL-034顺利推进临床并实现商业化,凭借着更优的疗效和临床数据,其有望快速获得市场的青睐,并有可能实现超过TALVEY®的销售额。
除此之外,根据弗若斯特沙利文的资料,公司另一款CD3 T-cell engager LBL-033是全球仅有的两款已进入临床阶段的MUC16/CD3双抗之一,在此前的临床前及早期临床研究中已经展现出强大的抗肿瘤活性及可控的安全性。目前,LBL-033已经获得NMPA及FDA的IND批准,正在中国开展单药治疗晚期实体瘤的I/II期临床研究。
而在单抗领域,根据弗若斯特沙利文的资料,维立志博的LBL-007是全球临床进度前三靶向LAG3的单克隆抗体之一,并且还是同类抗体中首款被证实对鼻咽癌有效的抗体,临床试验适应症数量在同类产品中也位居前列。
据悉,LBL-007目前正于中国及全球就多种癌症适应症进行II期临床试验,除了鼻咽癌以外,还广泛覆盖非小细胞肺癌、结直肠癌、头颈部鳞状细胞癌、食管鳞状细胞癌。
总体而言,“全球首款”、“全球前三”等多个领先头衔,足以体现出维立志博在药物研发上的前瞻性和创新能力。
进一步来看,这些候选药物在临床试验中展现出的良好疗效,不仅反映出公司对患者需求的深刻理解,也验证了其将这些需求转化为切实可行治疗方案的能力。
拥有真正源头创新研发能力,深受业内青睐与背书
当然,维立志博的产品管线能够如此具有突破性,很关键的因素在于其拥有真正源头创新的研发能力,我们不妨从内部及外部两个视角来探讨。
向内看,维立志博拥有全流程的研发链条和全面整合的开发能力,并开发出多个专有的创新技术平台,这使得公司在药品开发的过程中能够显著提高成功率。
这些平台包括LeadsBodyTM(CD3 T-cell engager平台)、X-bodyTM(4-1BB engager平台)以及其他几种双特异性抗体及融合蛋白平台,能够针对不同靶点、作用机制及药物类型持续进行药物创新,适用于多种疾病领域,为公司提供了持续的增长动力。
例如,LeadsBodyTM平台的优势可以简单概括为三点:首先,其能够优化肿瘤相关性抗原与CD3结合域的比例及亲和力,将T-cell engager作用导向肿瘤部位,降低脱靶毒性。其次,该平台可以通过结构优化,诱导T细胞有效杀伤靶细胞,减少细胞因子分泌。最后,在体外及体内研究中,通过平台研发出的T-cell engager展现出持久的抗肿瘤效果,且诱导的T细胞耗竭较少。LBL-034和LBL-033良好的临床数据就充分验证了LeadsBody™平台在开发强效CD3 T-cell engager方面的优越性。
而X-bodyTM平台则应用先进的抗体工程技术平衡肿瘤相关性抗原与4-1BB之间的亲和力,仅在肿瘤部位与肿瘤相关性抗原结合时促进4-1BB受体的交联与激活,从而在表达肿瘤相关性抗原的肿瘤微环境中激活4-1BB。这种独特的分子结构能够增强肿瘤微环境中的免疫应答,同时降低全身毒性的风险,公司的核心产品LBL-024就是基于X-body™平台所开发的。
此外,公司的其他技术平台也能够设计基于多种药物类型抗体的候选产品,例如常见的轻链双特异性抗体、双功能融合蛋白及ADC等在全球范围内针对极具竞争力的靶点。这些平台利用创新分子工程技术创造具有双重功能的专用药物,或通过精准靶向肿瘤细胞来减少全身副作用,能够进一步巩固公司在全球创新药市场中的领先地位。
通过内部创新能力和技术平台的强大实力,维立志博精准聚焦于市场上尚未得到充分满足的治疗需求,并且还计划将研发范围扩展到更多的大病种,为其在全球创新药领域中的核心竞争力增添了新的维度。同时,这也意味着公司能够更好地应对市场变化,把握行业发展的新趋势,从而在全球创新药领域中保持领先地位。
向外看,维立志博通过其极具全球竞争力的产品管线,与全球各知名药企进行BD合作,拓展全球价值体系,并构建出长期可持续的商业模式。这些合作不仅证明了公司的创新研发能力得到业内的认可和背书,也为日后其全球市场的推广和商业化铺平了道路。
例如,维立志博与百济神州的合作便是一个典型的案例。
维立志博授予百济神州在大中华区以外开发、生产及商业化LBL-007的独家许可,双方共同进行针对大癌种的LBL-007的临床开发及商业化,合作金额高达7.72亿美元的预付款及里程碑付款,另加双位数百分比的分级全球销售分成。这一合作有望借助百济神州在药物开发及商业化方面的丰富经验和销售渠道,加速LBL-007的全球注册及上市进程,为维立志博的创新成果在全球范围内的推广奠定坚实基础。
此外,在近期TCE(T cell-engager)出海大热的环境下,维立志博与Aditum Bio共同成立新药研发公司Oblenio Bio,就LBL-051(一款CD19/BCMA/CD3 T cell engager)的全球开发及商业化达成合作,总金额高达6.14亿美元,另加潜在中个位数百分比的全球销售分成及新公司的股权,后续国际化路径清晰可见。
不可否认,通过其内部创新能力和战略性的全球合作,维立志博不断强化自身的创新研发实力,在增强公司全球创新药领域影响力的同时,也带来了更多的增长机会和市场竞争力。
结语
在当今创新药研发的激烈竞争中,靶点同质化已成为行业内的一个普遍挑战。面对这一现状,创新药企必须寻求差异化的策略来确保其长期的市场竞争力和可持续发展。
维立志博手握LBL-024、LBL-034、LBL-033以及LBL-007等差异化药物,创新领先优势不言而喻。这些药物的创新性不仅体现在它们的靶点选择上,还体现在它们独特的作用机制和治疗潜力上。
凭借这些产品优势带来的独特市场定位和增长潜力,相信此次维立志博递表港股上市,有望获得更多市场关注,迈入一个全新的发展阶段。




