當前,雙抗賽道的熱度和活躍度快速上升,已經成為全球創新藥行業的新熱點,跨國藥企們紛紛“掃貨”,積極尋覓並投資有潛力的雙抗管線。
根據格隆匯統計,2024年前三個季度,全球藥企在雙抗藥物領域的交易活動異常活躍,共達成31筆交易。這一數字超過了過去三年中任何一年的全年交易量,足以顯示出雙抗藥物在全球醫藥市場中的地位和影響力正在迅速上升。
其中,僅11月就發生了5起關於雙抗/三抗藥物的大額BD交易,高額的合作金額充分揭示了雙抗賽道的巨大商業價值。
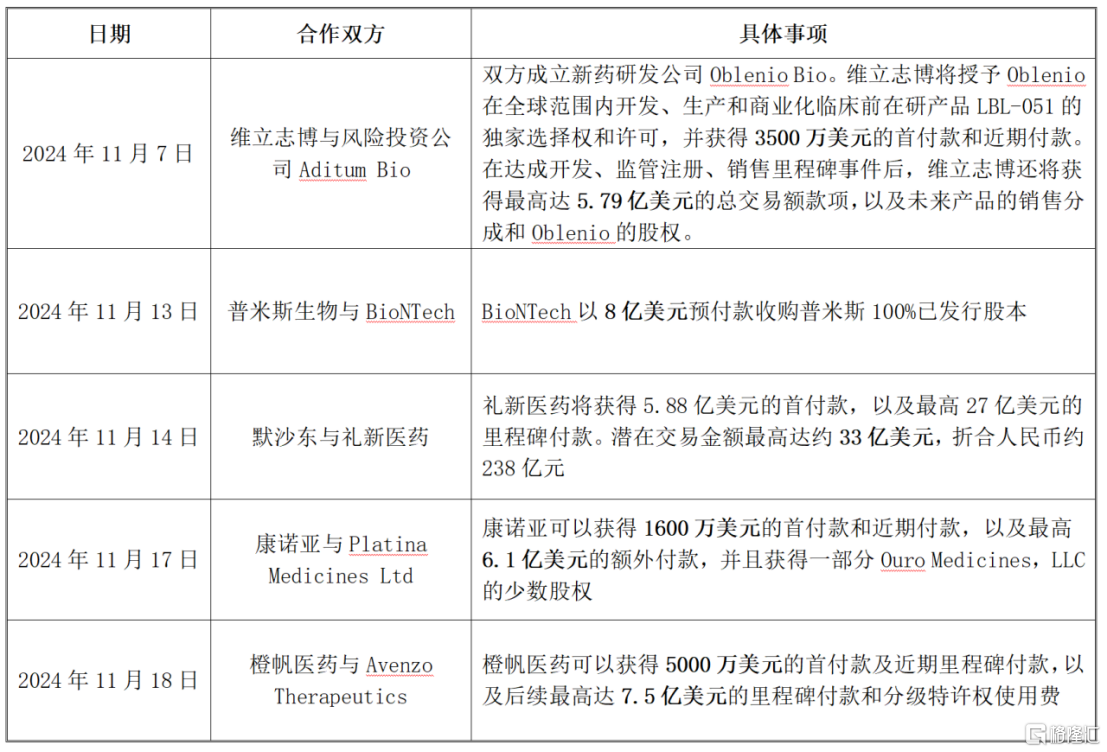
資料來源:格隆匯根據網絡公開信息整理
為什麼資本和全球各大藥企如此青睞雙抗藥物?
從腫瘤免疫療法的發展歷程來看,雖然以PD-1單抗為代表的上一代腫瘤免疫療法能夠取得約20%的客觀緩解率,但由於腫瘤微環境的複雜性和變異性,其療效普遍有限,且無法持久。
由此,以雙抗為代表的下一代腫瘤免疫療法出現,展現出更高的治療潛力。在這一階段,免疫檢查點抑制劑開始與化療或抗血管生成藥物聯合使用,顯著將客觀緩解率提升至40%至50%。並且現如今,為了達到更高的客觀緩解率,4-1BB和PD-L1組合、LAG3與PD-1聯合靶向等具有新靶點且前景廣闊的聯合療法出現,能夠系統性靶向多種免疫途徑,全面激活免疫系統,以實現最大化的抗腫瘤效果,引領着腫瘤免疫療法的未來方向。據弗若斯特沙利文數據統計,免疫療法有望於2030年佔據全球腫瘤治療市場的近一半市場份額。
當然,這種商業價值的體現,也反映在市場規模的增長上。藥智網數據顯示,2023年全球雙抗藥物市場規模已達88億美元,同比增長50%,進一步證實了雙抗藥物市場的潛力和活力。
在這樣的市場環境下,投資者對於雙抗領域的關注度也隨之提高,其中不乏藴藏着一些值得關注的投資機會。
近日,維立志博遞表港交所,或是一個值得觀察的案例。
在目前雙抗賽道高熱度的背景下,根據弗若斯特沙利文的資料,維立志博的四大核心及主要產品(雙抗LBL-024、LBL-034、LBL-033以及單抗LBL-007)不僅在產品設計上展現出創新性,而且臨牀研究進度不論於其各自藥物類別或就相同靶點均也處於全球領先水平。管線佈局的創新性和前瞻性,使其已經成為下一代腫瘤免疫治療開發的領跑者。
可以説,維立志博遞表港交所的時機也是恰逢其時,在為公司本身帶來資本市場關注的同時,也為投資者把握這一高增長賽道提供了一個窗口。
探索差異化靶點,全球FIC/BIC彰顯創新硬實力
在全球創新藥研發領域,一家公司要想站穩腳跟,手裏的牌必須得過硬——也就要看到產品的創新性以及臨牀應用潛力。
自成立以來,維立志博致力於滿足中國及全球在腫瘤、自身免疫性疾病及其他重大疾病方面未被滿足的醫療需求,憑藉着差異化創新和廣泛的治療領域覆蓋,在雙抗、單抗以及ADC等多種藥物領域均有佈局,而且都擁有全球商業權利,提前鋪墊出一條多元增長路徑。
目前,公司已經建立起一條擁有12款候選藥物的產品管線,包括針對腫瘤的3款單抗、4款雙抗、2款ADC和1款雙特異性融合蛋白,以及針對自身免疫性疾病的1款雙特異性融合蛋白及1款三特異性抗體。其中6款產品已進入臨牀階段,包括核心產品LBL-024以及主要產品LBL-034、LBL-033、LBL-007,且研發進展都處於全球領先水平,彰顯出其在創新藥研發領域的強勁實力。


資料來源:維立志博招股書
例如,在雙抗領域,維立志博的核心產品LBL-024是一種關鍵性臨牀階段的新型PD-L1與4-1BB雙抗,有望成為全球首款靶向4-1BB的免疫療法。
全球第一波以PD-1/PD-L1免疫檢查點抑制劑為代表的腫瘤免疫療法,其單藥治療也只實現20%的客觀緩解率。LBL-024正是通過雙靶向策略,利用這兩種通路的協同效應,實現強大的療效及可控的毒性之間的平衡,提供了更加安全且有效的治療方案,是PD-1/L1免疫治療的理想補充。
這裏值得注意的是,4-1BB作為共刺激激動劑,單抗開發之路充滿重大挑戰,尤其是安全性問題。從臨牀數據上來看,LBL-024無論是單藥還是與化療聯用,都顯示出良好的安全性。在已完成的單藥療法I/II試驗中,175名患者(II期111名患者)接受0.2mg/ kg至25mg/kg每三週一次的大劑量給藥治療,未觀察到或達到劑量限制性毒性。絕大多數不良事件為1級或2級且可控制。而與化療聯用的Ib/II期試驗中,截至2024年9月30日,在入組接受劑量6mg/kg、10mg/kg及15mg/kg的47名一線肺外神經內分泌癌患者中,亦未觀察到劑量限制性毒性,且劑量達到15mg/kg時未達到最大耐受劑量。
除此以外,在單藥治療觀察到的療效數據一樣令人鼓舞,截至2024年9月30日,在45名二線╱三線以上肺外神經內分泌癌的可評估患者中,有15名達到了部分緩解,8名達到了疾病穩定,即客觀緩解率為33.3%及疾病控制疾率為51.1%。針對肺外神經內分泌癌,公司已啟動單臂關鍵性臨牀試驗。
同時,4-1BB及PD-L1的廣泛表達使其在多個適應症中具有成藥潛力,其應用範圍廣泛,可擴展到多種實體瘤。此前弗若斯特沙利文數據顯示,4-1BB抗體主要的適應症病例總數呈現逐年上升態勢,從2016年的971.7萬例增至2020年的1063.4萬例。
目前,維立志博正在進行LBL-024針對治療晚期肺外神經內分泌癌、小細胞肺癌、膽道癌、非小細胞肺癌及其他實體瘤療效的臨牀研究,並計劃將進一步拓展至食管鱗狀細胞癌、胃癌及肝細胞癌等更多癌症適應症領域。
短短不到三年時間,LBL-024就從首次人體實驗進入針對肺外神經內分泌癌的單臂關鍵性臨牀試驗,展現出良好的療效性和安全性,是全球達到關鍵性臨牀試驗階段的首款4-1BB靶向候選藥物,有望成為該適應症的首款獲批藥物。據悉,LBL-024已獲NMPA授予治療後線肺外神經內分泌癌的突破性療法認定,並獲得美國FDA授予的治療神經內分泌癌的孤兒藥認定。
另一款主要產品LBL-034,則是一款全球臨牀進度第二領先的靶向GPRC5D及CD3 T-cell engager。
從最新臨牀進展來看,LBL-034已經取得NMPA及美國FDA的IND批准,正在中國進行鍼對治療複發性╱難治性多發性骨髓瘤的I/II期試驗。
數據顯示,截至2024年11月22日,在400μg/kg劑量的治療中,LBL-034的客觀緩解率(ORR)達到88.9%,達到VGPR(高質量緩解)或更好療效比例為66.7%,以及在800μg/kg劑量中ORR達100.0%;相較於全球唯一獲批GPRC5D/CD3雙抗——強生公司TALVEY®(塔奎妥單抗)的公開臨牀數據顯示,於劑量為800μg/kg的多發性骨髓瘤患者中,達到VGPR(高質量緩解)或更好療效的比例為52%。LBL-034展現出更優療效。這一結果不僅證明了LBL-034的潛力,也為未來的市場競爭奠定基礎。根據強生的銷售額預測,TALVEY®的全球年銷售峯值將達到50億美元。
由此不難判斷,若後續LBL-034順利推進臨牀並實現商業化,憑藉着更優的療效和臨牀數據,其有望快速獲得市場的青睞,並有可能實現超過TALVEY®的銷售額。
除此之外,根據弗若斯特沙利文的資料,公司另一款CD3 T-cell engager LBL-033是全球僅有的兩款已進入臨牀階段的MUC16/CD3雙抗之一,在此前的臨牀前及早期臨牀研究中已經展現出強大的抗腫瘤活性及可控的安全性。目前,LBL-033已經獲得NMPA及FDA的IND批准,正在中國開展單藥治療晚期實體瘤的I/II期臨牀研究。
而在單抗領域,根據弗若斯特沙利文的資料,維立志博的LBL-007是全球臨牀進度前三靶向LAG3的單克隆抗體之一,並且還是同類抗體中首款被證實對鼻咽癌有效的抗體,臨牀試驗適應症數量在同類產品中也位居前列。
據悉,LBL-007目前正於中國及全球就多種癌症適應症進行II期臨牀試驗,除了鼻咽癌以外,還廣泛覆蓋非小細胞肺癌、結直腸癌、頭頸部鱗狀細胞癌、食管鱗狀細胞癌。
總體而言,“全球首款”、“全球前三”等多個領先頭銜,足以體現出維立志博在藥物研發上的前瞻性和創新能力。
進一步來看,這些候選藥物在臨牀試驗中展現出的良好療效,不僅反映出公司對患者需求的深刻理解,也驗證了其將這些需求轉化為切實可行治療方案的能力。
擁有真正源頭創新研發能力,深受業內青睞與背書
當然,維立志博的產品管線能夠如此具有突破性,很關鍵的因素在於其擁有真正源頭創新的研發能力,我們不妨從內部及外部兩個視角來探討。
向內看,維立志博擁有全流程的研發鏈條和全面整合的開發能力,並開發出多個專有的創新技術平台,這使得公司在藥品開發的過程中能夠顯著提高成功率。
這些平台包括LeadsBodyTM(CD3 T-cell engager平台)、X-bodyTM(4-1BB engager平台)以及其他幾種雙特異性抗體及融合蛋白平台,能夠針對不同靶點、作用機制及藥物類型持續進行藥物創新,適用於多種疾病領域,為公司提供了持續的增長動力。
例如,LeadsBodyTM平台的優勢可以簡單概括為三點:首先,其能夠優化腫瘤相關性抗原與CD3結合域的比例及親和力,將T-cell engager作用導向腫瘤部位,降低脱靶毒性。其次,該平台可以通過結構優化,誘導T細胞有效殺傷靶細胞,減少細胞因子分泌。最後,在體外及體內研究中,通過平台研發出的T-cell engager展現出持久的抗腫瘤效果,且誘導的T細胞耗竭較少。LBL-034和LBL-033良好的臨牀數據就充分驗證了LeadsBody™平台在開發強效CD3 T-cell engager方面的優越性。
而X-bodyTM平台則應用先進的抗體工程技術平衡腫瘤相關性抗原與4-1BB之間的親和力,僅在腫瘤部位與腫瘤相關性抗原結合時促進4-1BB受體的交聯與激活,從而在表達腫瘤相關性抗原的腫瘤微環境中激活4-1BB。這種獨特的分子結構能夠增強腫瘤微環境中的免疫應答,同時降低全身毒性的風險,公司的核心產品LBL-024就是基於X-body™平台所開發的。
此外,公司的其他技術平台也能夠設計基於多種藥物類型抗體的候選產品,例如常見的輕鏈雙特異性抗體、雙功能融合蛋白及ADC等在全球範圍內針對極具競爭力的靶點。這些平台利用創新分子工程技術創造具有雙重功能的專用藥物,或通過精準靶向腫瘤細胞來減少全身副作用,能夠進一步鞏固公司在全球創新藥市場中的領先地位。
通過內部創新能力和技術平台的強大實力,維立志博精準聚焦於市場上尚未得到充分滿足的治療需求,並且還計劃將研發範圍擴展到更多的大病種,為其在全球創新藥領域中的核心競爭力增添了新的維度。同時,這也意味着公司能夠更好地應對市場變化,把握行業發展的新趨勢,從而在全球創新藥領域中保持領先地位。
向外看,維立志博通過其極具全球競爭力的產品管線,與全球各知名藥企進行BD合作,拓展全球價值體系,並構建出長期可持續的商業模式。這些合作不僅證明了公司的創新研發能力得到業內的認可和背書,也為日後其全球市場的推廣和商業化鋪平了道路。
例如,維立志博與百濟神州的合作便是一個典型的案例。
維立志博授予百濟神州在大中華區以外開發、生產及商業化LBL-007的獨家許可,雙方共同進行鍼對大癌種的LBL-007的臨牀開發及商業化,合作金額高達7.72億美元的預付款及里程碑付款,另加雙位數百分比的分級全球銷售分成。這一合作有望藉助百濟神州在藥物開發及商業化方面的豐富經驗和銷售渠道,加速LBL-007的全球註冊及上市進程,為維立志博的創新成果在全球範圍內的推廣奠定堅實基礎。
此外,在近期TCE(T cell-engager)出海大熱的環境下,維立志博與Aditum Bio共同成立新藥研發公司Oblenio Bio,就LBL-051(一款CD19/BCMA/CD3 T cell engager)的全球開發及商業化達成合作,總金額高達6.14億美元,另加潛在中個位數百分比的全球銷售分成及新公司的股權,後續國際化路徑清晰可見。
不可否認,通過其內部創新能力和戰略性的全球合作,維立志博不斷強化自身的創新研發實力,在增強公司全球創新藥領域影響力的同時,也帶來了更多的增長機會和市場競爭力。
結語
在當今創新藥研發的激烈競爭中,靶點同質化已成為行業內的一個普遍挑戰。面對這一現狀,創新藥企必須尋求差異化的策略來確保其長期的市場競爭力和可持續發展。
維立志博手握LBL-024、LBL-034、LBL-033以及LBL-007等差異化藥物,創新領先優勢不言而喻。這些藥物的創新性不僅體現在它們的靶點選擇上,還體現在它們獨特的作用機制和治療潛力上。
憑藉這些產品優勢帶來的獨特市場定位和增長潛力,相信此次維立志博遞表港股上市,有望獲得更多市場關注,邁入一個全新的發展階段。




