隨着醫改進入深水區,如何才能在政策密集發佈下破繭成蝶,成為眾多中國藥企面臨的問題。當下,擺在藥企面前的出路,一是加強創新研發,走出產品的差異化,二是“走出去”,進行全球化輸出。在眾多醫藥企業中,筆者認為歌禮制藥的發展路徑——研發驅動結合國際化佈局,是一個符合行業進化升級的好選擇,應該引起投資者的重視。
2021年8月26日晚,歌禮制藥-B(1672.HK)發佈了截至2021年6月30日止6個月的中期業績公吿。2021年上半年,公司實現銷售收入3654.9萬元,同比增長14.8%。公司的研發開支為7402.6萬元,同比增加43.1%。
高效研發成果顯著,佈局前瞻全球領先
歌禮制藥聚焦於非酒精性脂肪性肝炎(NASH)、腫瘤(脂質代謝與口服檢查點抑制劑)、病毒性疾病(乙肝)等領域。公司最大化利用研發資金,打造了18條創新管線,並取得了突破性的進展。
創新藥企想要佔據先發優勢,加快研發進程是一個關鍵因素。據公司半年報顯示,歌禮制藥加快了臨牀研發的進展。從進度上來看,公司在研發費用可控的情況下,上半年共有5項中國IND和1項美國IND獲批,分別為ASC40-NASH、ASC42-NASH、ASC40-rGBM、ASC42-HBV、ASC40-痤瘡的中國IND和ASC41-NASH的美國IND。已有4項管線新進入II期和III期臨牀試驗。
其中,ASC40對於複發性膠質母細胞瘤(rGBM)的適應症啟動了中國III期臨牀試驗,據公司公開資料顯示,公司預計在未來12個月內完成80%的受試者入組;ASC40在NASH的研究也進入美國IIb期臨牀試驗,公司預計將在未來12個月內獲得該試驗的中期結果;ASC42治療慢性乙肝(HBV)和ASC40的痤瘡適應症開啟了中國II期臨牀試驗研究,公司也預計在未來12月內獲得這兩項試驗的頂線數據。
當下,市場已經充分認識到研發過度競爭的弊端,侷限於中國權益的創新藥企,由於超額的研發投入不足以覆蓋未來的收入,開始受到市場的質疑。而歌禮制藥的產品佈局前瞻,着眼於全球化的權益。
不僅如此,相較於其他創新藥企動輒上億的研發投入,公司在研發方面的花費不算太高,卻取得了較為理想的成效,比如從臨牀試驗的進度來看,公司憑藉快速入組的能力以及高效的臨牀推動,使得多個候選藥物領跑行業。
公司在NASH領域的候選藥物ASC40,是一款同類第一的口服脂肪酸合成酶(FASN)抑制劑。公司在FASN賽道的研發進度全球第一,僅4個月就完成了30名患者中國II期臨牀試驗的入組,一項隨機、雙盲、安慰劑對照、以肝臟活檢為主要療效終點的IIb期臨牀試驗已由合作伙伴Sagimet正式啟動。公司計劃在完成美國IIb期試驗後啟動包括中國和美國在內的全球多中心III期臨牀試驗。
公司第二個領先的NASH候選藥物ASC42,是一款由歌禮制藥旗下的甘萊製藥完全自主研發、有望成為同類最佳的新型高效選擇性非甾類FXR激動劑。公司僅花費6個月,就在64名受試者的美國I期臨牀試驗中,取得了良好的安全性和藥效學生物標誌物頂線數據,公司計劃未來12個月內在美國遞交以肝臟活檢為主要療效終點的IIa/IIb期適應性臨牀試驗申請,相較於其他公司在同樣靶點藥物的研發速度,歌禮的研發效率值得肯定。
除此之外,公司候選藥物ASC41在THR-β賽道研發進度全球第三、中國第一,這款肝臟靶向性前體藥物,其活性代謝產物可選擇性激活甲狀腺激素受體β(THR-β),已完成兩項I期臨牀研究,公司計劃在未來12個月內在美國完成以肝臟活檢為主要療效終點的IIa/IIb期適應性臨牀試驗的首個患者給藥。
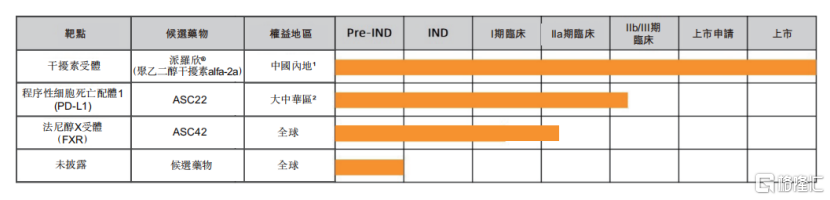
圖一:歌禮制藥的NASH產品管線進展

資料來源:歌禮制藥2021年半年報,格隆彙整理
另外,公司在慢性乙肝臨牀治癒領域,ASC22聯合核苷(酸)類似物的中國IIb期臨牀試驗,僅用時7個月就完成了149名患者IIb期入組並取得良好中期結果。同領域的候選藥物ASC42,僅用時2.5個月就從IND獲批到完成中國橋接試驗並啟動II期臨牀試驗。據公司的公開資料顯示,公司預計在未來12個月內獲得這兩項II期臨牀試驗的頂線數據。
圖二:歌禮制藥慢性乙肝產品管線進展
資料來源:歌禮制藥2021年半年報,格隆彙整理
縱向拓展現有產品,創新發現價值升維
歌禮制藥在橫向發展不同靶點的創新產品同時,還深入挖掘縱向拓展現有產品的潛力適應症。歌禮制藥具有敏鋭的市場發現能力,在同靶點適應症方面創新性開發,將公司的候選產品ASC40應用於rGBM和痤瘡等領域,以填補未被滿足的巨大醫療需求缺口,進而實現候選藥物的價值升維。
從複發性膠質母細胞瘤(rGBM)的治療格局來看,據發表數據,作為最常見和致命的原發性腦腫瘤,膠質母細胞瘤(GBM)在中國年發病率較高,每年新發GBM病例約4萬-6.4萬例,而且GBM的複發率極高,超過90%的GBM患者在手術、放療、化療後會出現復發,而患者在接受放化療之後,已經沒有了標準的護理。
應用於rGBM適應症,歌禮制藥的候選產品ASC40進展還較為迅速。2021年7月,中國NMPA批准開展ASC40聯合貝伐珠單抗治療rGBM患者的III期臨牀試驗。此外,公司不侷限於rGBM,還計劃開展針對多種實體瘤適應症的II期臨牀試驗。
圖三:歌禮制藥腫瘤產品管線進展
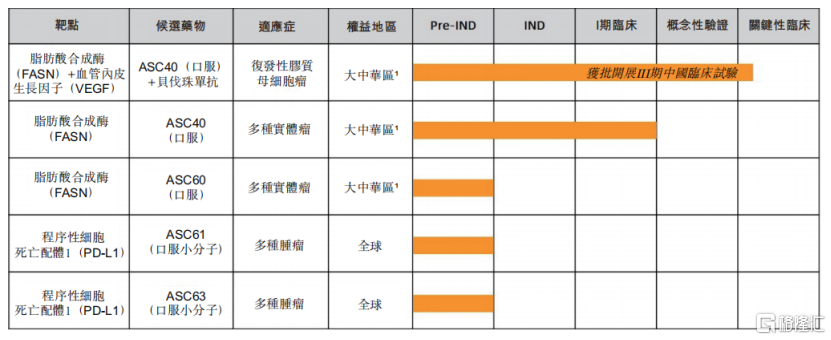
資料來源:歌禮制藥2021年半年報,格隆彙整理
而痤瘡是世界第八大流行疾病,全球痤瘡患者人數超過6.4億人,據Allied Market Research最近發佈的報吿顯示,2019年,全球痤瘡藥物市場規模為118.6億美元,摺合人民幣770.9億元。目前,治療痤瘡的一線藥物主要為一些外用乳膏,如維甲酸類、雄激素受體抑制劑等藥物。這類藥物只能治療表面症狀,甚至會導致損傷肝功能等嚴重副作用。
基於痤瘡領域存在較大的市場需求,為治療中、重度痤瘡患者,歌禮制藥拓展了ASC40在痤瘡領域的適應症,並於2021年8月獲中國NMPA批准開展II期臨牀試驗。據公司的公開資料顯示,公司預計在未來12個月內獲得這項II期臨牀試驗的頂線數據。
圖四:歌禮制藥痤瘡產品管線進展
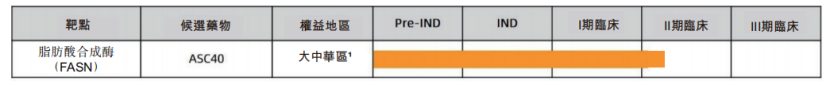
資料來源:歌禮制藥2021年半年報,格隆彙整理
結語
此次半年報業績披露,筆者注意到,歌禮制藥在現有產品的臨牀研究方面,開始加快進度,極大程度地提高了公司的研發效率,多款候選藥物已經達到了全球領先的水平。
不僅如此,歌禮制藥更是深謀遠慮,候選藥物看中的是全球範圍的權益,併合理佈局產品管線。同時,公司創新性地挖掘市場需求,進行縱向拓展,開發更多種類的適應症,進而提高產品的市場空間,實現價值升維。
所以,歌禮制藥憑藉着在研發、創新、國際化等方面的優勢,不斷提升公司的創新驅動力,將打破當下中國醫藥行業研發過度競爭的困局,有望從Biotech發展成為Bio Pharma乃至Big Pharma,就讓我們拭目以待。




