本文來自格隆匯專欄:醫藥魔方 作者:肖恩
全球肆虐的新冠疫情促使美國FDA於2021年8月23日和2022年1月31日完全批准了兩款新冠疫苗,分別是輝瑞/BioNTech合作開發的Comirnaty(BNT162b2)與Moderna公司開發的Spikevax(mRNA-1273)。這2款疫苗都是mRNA疫苗。
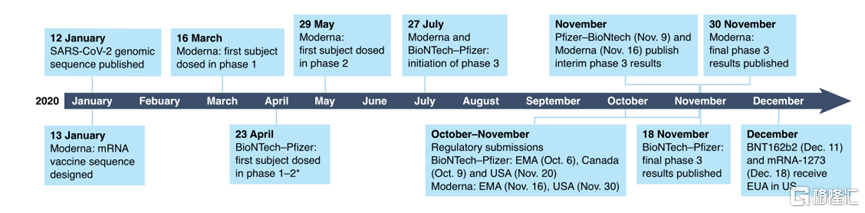
新冠病毒序列於2020年1月11日公佈,數週之後的3月16日,mRNA-1273就完成首例受試者接種。可以説,這兩款疫苗的快速獲批,離不開研究人員數十年如一日地深耕傳染病與腫瘤領域的mRNA疫苗研究。
2020年,新冠mRNA疫苗賽道研究火熱(來源:Nature Biotechnology)
1990年,Wolff等人首次發現,mRNA可以在體內翻譯出蛋白質,從而證明了mRNA可用於疫苗接種。而幾十年後的今天,這項技術才真正在臨牀獲得驗證。這其中的原因部分來自於2000年左右mRNA的穩定性與遞送方面出現技術困難,行業研發重點和資金流向暫時轉向DNA疫苗技術。
然而,mRNA設計與製造的簡便性、固有的免疫原性、快速量產性以及微不足道的插入突變性仍然深深地吸引着一些研究人員,他們繼續從事着mRNA疫苗的研究。
mRNA技術的一項格外重要的優勢在於mRNA可以作為蛋白翻譯的模板。傳統的疫苗工藝依賴於生物反應裝置或雞蛋中使用哺乳動物細胞批量生產疫苗,而mRNA疫苗只需在接種者體內經過一次轉化就可以發揮作用。實際上,mRNA正是利用人體作為“生物反應裝置”,這一過程天生具有以下幾項優勢:
首先,mRNA允許人體對編碼蛋白進行翻譯後修飾(PTM),這種蛋白免疫原性低、可完全發揮作用。其次,在生物反應器中不能產生的多聚體蛋白可以在接種者細胞內完成正確的翻譯、摺疊和組裝。例如,Moderna公司鉅細胞病毒(CMV)mRNA-1647疫苗是5種mRNA的混合物,體內可產生五聚體蛋白。此外,mRNA療法可以產生跨膜蛋白和細胞內蛋白,並可在細胞中將這些蛋白轉運到適當的位置發揮作用。

mRNA-1647組成(來源:Moderna公司官方Facebook)
在病毒載體疫苗中,若患者之前接觸過這種病毒,體內可能存在針對這種病毒的抗體;而接種過這種疫苗後,體內也會產生相應抗體,不利於後續加強針的療效。因此,這類疫苗的適用人羣有限。而mRNA疫苗出現這種現象的可能性較小。
與其他藥物類型一致,mRNA的劑量與給藥間隔需要按照接種者的實際情況(體重、健康狀況等)做出調整。此外,由於疫苗的作用時間有限,不可逆副作用的可能性較小,僅需針對接種後的急性症狀加以治療。由於mRNA降解受正常細胞功能調控,mRNA的體內半衰期可以通過分子修飾與遞送方法調節。
mRNA藥物可分為3類,即預防性疫苗、治療性疫苗以及治療性藥物(protein-encoding therapies),其開發過程均需要解決將mRNA遞送至靶細胞,同時維持mRNA的結構穩定性的難題。
RNA分子本身不穩定。目前,提高mRNA穩定性的技術包括優化5’帽子結構 (5’Cap)、調整3’Poly(A)尾長度以及修飾5’和3’非翻譯區中的調控元件。
除了優化mRNA體內穩定性之外,還需要有效的細胞遞送。十多年的研究發現,以脂質納米粒(LNP)遞送mRNA可以有效解決這一問題。LNP中,磷脂(如二硬脂酰磷脂酰膽鹼,DSPC)組成類似細胞膜的脂質雙分子層,其中插入的膽固醇可以調節脂質雙分子層的流動性。聚乙二醇(PEG)可提高膠體穩定性,並減少調理作用(抗體、補體與吞噬細胞表面結合,促進吞噬細胞吞噬細菌等顆粒性抗原的作用)。膠束內部為陰性RNA,可與脂質雙分子層中的離子型或陽離子LNP電荷相互作用,提高穩定性。
聚合物納米粒子(polymeric nanoparticles,PNPs)是另一類具有潛力的遞送載體。PNPs可以與磷脂、膽固醇和PEG組裝,實現不同的理化性質。LNPs和PNPs都可以進一步以特異性的配體修飾,提高細胞靶向能力。

mRNA遞送系統的結構組成(來源:Nature Biotechnology)
當mRNA作為疫苗使用時,需要適當的免疫原性激活人體免疫系統;而利用mRNA翻譯出特定蛋白髮揮治療作用時,則希望避免免疫原性。這是mRNA藥物的生產與處方開發中需要重點考慮的因素。作為RNA病毒遺傳物質或DNA病毒複製副產物的RNA可以對固有免疫系統產生強烈的刺激。微生物RNA有許多結構和序列特徵,人體免疫系統可以將微生物RNA與宿主RNA區分開來。機體2種模式識別受體(PRRs)可識別病原微生物的某些保守組分,即病原相關分子模式(PAMPs),通過激活受體特異性的信號轉導通路,誘導促炎症因子和I型干擾素(IFN-1)的表達,產生非特異性抗病原微生物反應。
第一種PRR為Toll樣受體(TLR)系統,位於上皮細胞和免疫細胞(如DC細胞、單核細胞與巨噬細胞)的細胞膜、內涵體與溶酶體上。第二種為維甲酸誘導基因I(RIG-I)樣受體,位於絕大多數細胞的細胞質中。TLR3被雙鏈RNA(dsRNA)激活,而TLR7和TLR8由單鏈RNA激活。RIG-I和黑色素瘤分化相關蛋白5(MDA5)在細胞質中分別被短(18-19bp)和長的(>1000 bp)的dsRNA激活。TLR3激活將通過包含TIR結構域的接頭蛋白1(TICAM-1)信號通路產生IFN-1,而其他TLRs利用髓樣分化蛋白MyD88依賴的級聯反應介導核因子κB(NFκB)依賴的或干擾素調節因子(IRF)3依賴的方式產生促炎細胞因子。需要根據臨牀應用考慮上述信號通路被mRNA藥物及其遞送載體激活的程度。
預防性mRNA疫苗
Comirnaty與Spikevax獲FDA批准意味着傳染病防治的劃時代的進步。然而,該領域還需要除了新冠以外的疾病驗證。
mRNA分子固有的免疫刺激性使其可同時作為免疫佐劑,提高人體免疫水平。然而,產品開發過程中需要平衡免疫刺激性與編碼抗原表達的關係。Oliwia Andries等人發現用N1-甲基假尿苷替代尿苷可以降低mRNA的免疫原性,且更能增強mRNA的蛋白表達能力。目前兩款獲批的新冠mRNA疫苗都採用N1-甲基假尿苷修飾,而未經修飾的CureVac新冠疫苗(CVnCOV)的新冠保護率僅為47%,試驗結果不盡人意。
針對這一現象,CureVac認為,在CVnCOV臨牀試驗過程中新冠病毒發生變異,與BNT162b2和mRNA-1273的試驗環境並不一致;也有人認為,未經修飾的RNA免疫反應性更強,CureVac選擇了更低的使用劑量(12 μg)(BNT162b2和mRNA-1273的使用劑量分別為30 μg與100 μg),但是這一劑量可能不足以產生有效的中和抗體反應。其他觀點則指出,未經修飾的RNA翻譯效率可能較低。
上述疫苗都是非複製型的mRNA疫苗。目前有幾個基於RNA聚合酶實現自我擴增型的mRNA疫苗,可以提高抗原蛋白的表達量。相關疫苗均處於早期臨牀試驗階段。相較於傳統疫苗,這種疫苗體積更大,遞送載體需要與其實現良好的配合。
1.提高安全性
mRNA疫苗沒有減毒活疫苗"毒力返祖"或在部分個體中誘發嚴重疾病的可能[80%的嬰幼兒接種呼吸道合胞病毒(RSV)減毒活疫苗後感染RSV、引發重症並住院,同時有患兒死亡]。而與DNA疫苗或某些病毒載體疫苗相比,mRNA疫苗不會整合到接種人羣DNA中引發插入突變風險。
2.縮短研發週期
新冠疫情在全球的大流行突顯了能夠快速應用於人體試驗疫苗技術的重要性。相對於傳統疫苗的開發週期,目前獲批的兩種新冠mRNA疫苗的開發時間縮短了11個月到幾年不等。
除上述公司,其他mRNA廠商也憑藉在mRNA領域積累的經驗快速開發疫苗。例如,CureVac的CVnCOV於2020年6月開始I期臨牀研究,一年後就公佈了臨牀II/III期試驗中期結果。
嚴峻的公共衞生問題推動了mRNA疫苗的加速開發,促使各藥企尋找縮短臨牀試驗時間的方法(例如,將原本應該逐步遞進的開發步驟同時進行、縮短前期研究時限、減少產品放行檢驗次數)。

在研臨牀II期與III期預防性mRNA疫苗(來源:Nature Biotechnology)
3.提高規模化生產效率
由於mRNA疫苗體內發揮作用不依賴活病毒,因此無需專門的實驗設備與生物安全實驗室。而與雞胚胎疫苗相比,mRNA疫苗不受雞胚產量的限制,同時可以用於對雞胚過敏羣體的疫苗接種。在生產過程中,無需培養活的細胞,因此也不存在細菌污染的風險。
組成mRNA疫苗的基本化學成分相同,因此,建立了一條mRNA疫苗生產線後,可以對新出現的或季節性的流行病做出快速反應。例如,新的新冠毒株出現後,可以採用原有遞送系統,更換編碼mRNA序列即可製備針對變異新冠毒株的疫苗。
4.快速的抗原特異性序列優化
mRNA技術的另一項優勢在於可以通過改變核酸序列來不斷優化編碼抗原,相對於製備不同蛋白或多肽的生物工程技術,這一過程相對更加簡單直接。BioNTech則充分利用了這項技術的靈活性。BioNTech將至少5個不同的新冠mRNA疫苗投入臨牀試驗(其中3種是核苷修飾的mRNA,一個使用了含有尿苷的mRNA,以及一個可以自我擴增型mRNA)。
5.編碼多種蛋白和/或蛋白亞基
對新冠病毒而言,刺突蛋白是一種同源三聚體,因此只需引入單個mRNA序列。而對於免疫原由多個不同亞基組成的病原體,生產多個亞基並按照化學計量學組成,成功的完成重組並構成完整蛋白的免疫原,其中的挑戰不言而喻。而mRNA可以輕鬆地完成上述步驟。這些獨立的亞基既可以同時編碼在同一個長mRNA中,也可以分散於各自獨立的mRNA鏈中。
例如,靶向CMV的疫苗含有6種mRNA。其中,5種mRNA分別編碼5種不同的蛋白質,這些蛋白完成組裝後可形成一個五聚體蛋白,而第6種mRNA編碼CMV的 gB糖蛋白(gB protein)。
同時,一個疫苗還可以同時靶向兩種不同的病原體。例如,mRNA-1653由2種mRNA組成,可靶向人類偏肺病毒(hMPV)和副流感病毒3型(PIV3)F蛋白。
6.調節mRNA免疫原性
除了通過改變mRNA序列優化抗原免疫原性之外,mRNA本身以及在mRNA製造過程中的其他RNA產物的固有免疫都可以用於增強免疫應答。
mRNA本身的先天免疫原性可能對疫苗接種有利,因為它可以激活免疫系統。如TLR系統受mRNA激活後,可誘導DC細胞成熟,進一步產生功能強大的B細胞和T細胞免疫反應。
這種RNA驅動的免疫反應也可能有害。前面提到的CureVac的CVnCoV結構未經修飾,可能導致RNA依賴性蛋白激酶R(PKR)激活,抑制mRNA翻譯。
目前,調節mRNA免疫原性主要的方法是核苷酸化學修飾。Kariko等人的研究報吿指出,假尿嘧啶與5-甲基胞苷可顯著降低TLR信號轉導與PKR激活,從而導致小鼠體內相應蛋白水平升高。值得注意的是,輝瑞與Moderna獲批的兩種新冠疫苗都將尿嘧啶替換為N1-甲基假尿苷。
其他的研究則指出,與核苷酸經過修飾的mRNA相比,未經修飾的mRNA在細胞與小鼠體內可觀察到更高的目的蛋白表達。有觀點認為,這項研究與此前觀點矛盾的原因可能是改進了mRNA純化方法以及除去了其他RNA干擾物質。以HPLC、快速蛋白液相色譜以及親和分析技術除去dsRNA大幅提高了翻譯效率。來自CureVac的研究人員報吿稱,經HPLC純化、序列優化後未經修飾的mRNA不具免疫原性,相對於化學修飾的mRNA可產生更高的蛋白水平。
最近,基因泰克的科學家報吿稱白介素(IL)-1β和IL-1受體激動劑是調控機體對mRNA反應的關鍵,因此,小鼠、非人靈長類動物和人體內調控元件的差異可能解釋了這些物種體內尿嘧啶修飾與未修飾mRNA反應原性的不同。
7.遞送mRNA的納米制劑
早期mRNA的接種形式為裸露的mRNA或魚精蛋白與mRNA緊密結合形成的納米顆粒。例如,狂犬病疫苗CV7201是採用魚精蛋白製備的,這種疫苗的免疫原性嚴重依賴於接種方式,只有一種利用無針裝置的皮內注射出現了預期的免疫反應。
目前,絕大多數mRNA藥物都採用LNPs遞送。FDA批准的首個RNA寡核苷酸藥物(patisiran,一種用於治療轉甲狀腺素蛋白澱粉樣變性心肌病與轉甲狀腺素蛋白家族性澱粉樣多發性神經病的RNAi藥物)即採用LNP遞送。此外,BioNTech新冠疫苗BNT162b2也是採用LNP系統遞送的。
脂質組成的鑑定、測試和生產對於疫苗進入臨牀試驗的速度非常重要。由於CMV疫苗mRNA-1647和hMPV–PIV3疫苗mRNA-153已有來自臨牀與監管部門的經驗,mRNA-1273使用了與上述二者一致的LNP。
LNP製劑的組成可顯著影響胞內遞送效率,決定遞送靶細胞的特異性並調控免疫原性。儘管組成LNPs的各種成分功能都必不可少,離子型脂質在RNA遞送的許多方面起着至關重要的作用,如微粒形成、細胞攝取與內涵體逃逸。
目前脂質開發重點關注引入水解基團促進清除,然而,這些可降解官能團將影響製劑的穩定性。將mRNA LNP凍幹是提高製劑穩定性的一個策略。但是,對於mRNA藥物中給藥劑量較低的應用場景(如疫苗),採用抗水解的脂質可能更加合適。
除了全身給藥的RNA納米顆粒外,其他類型的RNA給藥方式為其在神經系統、眼、心臟、肺部應用提供了基礎。需要尤其注意的是,基於生物降解聚合物、寡聚物和脂類的納米顆粒可使mRNA通過霧化給藥作用於肺上皮組織。例如,囊性纖維化患者反覆服用MRT5005,這是一種LNP遞送的mRNA霧化製劑,可編碼囊性纖維化跨膜調節蛋白。
8.貯藏與運輸
處方組成關係到儲存與運輸條件。2014-2016年埃博拉疫情期間,一種減毒重組水皰性口炎病毒疫苗(2019年獲批,商品名為Ervebo)必須在-80℃ ~ -60℃儲存,這在非洲疫情最嚴重的地區難以執行。這次事件凸顯了疫苗貯存的困難。
當下,新冠疫情影響全球,從全球應急準備來看,當務之急在於數以百萬的新冠疫苗需要運輸到全球各地,這些國家氣候差異巨大,同時也包括了很多醫療保健基礎較差的國家。
據報道,CureVac的CVnCoV疫苗在冰箱5°C下可保存至少3個月;室温條件下用於接種時,有效期僅為24 h。Moderna的mRNA1273在−20°C保存時限長達6個月,在冷藏條件下也可保存30天,但在室温僅可保持12 h的有效性。
首次人體試驗(FIH)通常參與的受試者與研究基地數量有限。有些情況下,試驗中採用的處方並不是最理想的。此時,製劑貯存穩定性的優化工作會與臨牀試驗同步進行。例如,Moderna的CMV候選疫苗mRNA-1647臨牀I期受試藥物為冷凍的液體制劑;而在臨牀II期時受試藥物已經變成凍乾製劑,冰箱中儲存18個月內穩定。
mRNA-1443的開發過程進一步強調了必須通盤考慮mRNA藥物運輸、貯存與穩定性。mRNA-1443靶向CMV磷酸蛋白65 T抗原。該藥物與mRNA-1647在同一臨牀試驗中評估。然而,2018年8月,由於mRNA-1443受試藥物穩定性不滿足接受標準,該藥物的開發從此被擱置。
以凍乾粉的形式貯存和運輸是mRNA藥物最常使用的方法。然而,在凍幹過程中由結晶和真空脱水產生的應力可能會降低生物大分子或LNPs的穩定性,導致活性喪失。有報道指出,向製劑中加入某些冷凍保護劑(如海藻糖、蔗糖和甘露醇)可以維持特定處方的穩定性。目前,輝瑞已經啟動了一項III期試驗,評估凍幹BNT162b2製劑與冷凍液體BNT162b2製劑安全性與耐受性的差異。
9.給藥方式
儘管目前獲批的新冠mRNA疫苗都選擇肌內注射,關於mRNA疫苗的最佳接種途徑還沒有達成共識。目前全球爆發的新冠疫情必然要求採用接種難度低的免疫方式,儘可能減少醫療人員的培訓成本。目前,BTN162b2、CVnCoV、ARCT021和mRNA-1273都選擇肌內注射;而來自倫敦帝國理工學院的研究人員則考慮通過吸入給藥實現mRNA疫苗的自我擴增。吸入或鼻滴疫苗可引發細胞和體液免疫,這種方式對包括新冠病毒在內的呼吸道傳染病防治中特別有效。然而,鼻腔內mRNA疫苗的研究目前仍停留在動物模型階段,需要開發基於LNP的mRNA遞送系統實現上呼吸道相關細胞的精準遞送以進一步評估效果。
在mRNA領域,皮內注射和肌內注射都可用於候選疫苗的評價,有些時候在同一研究中的同一疫苗會同時評估兩種給藥方式,因為這兩種給藥方式在免疫原性與耐受性方面可產生不同的結果。例如,mRNA-1440(H10N8流感病毒疫苗)臨牀I期試驗中在健康受試者體內分別評估了肌內注射(25–400 µg)和皮內注射(25–50 µg)。相較於肌內接種,皮內接種引起了更多的不良反應。皮內注射mRNA-1440 25 μg已經顯示出較肌內注射更強的免疫原性。但是3例肌內接種400 μg劑量mRNA-1440的受試者中,2例出現了嚴重的頭痛與紅斑等嚴重不良反應,因此安全委員會停止了這種給藥方式進一步的劑量爬坡試驗。
總的來説,肌內接種仍是各種疾病mRNA疫苗最常用的給藥方式。
10.給藥方案
對於新冠疫情的全球防治而言,最理想的給藥方案是單次給藥,即接種後可立即實現100%的血清轉化,但當下還沒有達到這種程度。目前採取的策略是加強免疫,即間隔數週內接受至少2次注射。例如,BNT162b2的接種方式為21天肌內接種2次;CvnCOv和mRNA-1273則在初始注射4周後進行加強免疫。
然而,由於早期疫苗短缺,以及單次注射後觀察到的部分保護現象,一些人開始主張向更大人羣單次免疫接種,而不是向接種人羣接種加強針;或者將接種間隔延長得比在臨牀試驗中的更長。一項針對80歲以上成年人的小型臨牀試驗結果表明,間隔3個月(而不是規定的3周)接種2針BNT162b2可提高抗體濃度峯值。
自我擴增型mRNA疫苗(如ARC-021和BNT162c2)則有望實現單針接種。例如,RSV疫苗mRNA-1345的I期臨牀試驗採用在2個月內接種3次的給藥策略,而III期臨牀中將考察單次接種結果。
儘管技術和抗原選擇上具有相似之處,在研新冠疫苗覆蓋了非常寬的劑量範圍。自我擴增型新冠mRNA疫苗每劑用量較小。例如,帝國理工學院自擴增新冠mRNA疫苗臨牀試驗劑量在0.1~1 μg之間;ARCT-021單次注射劑量為1~10 μg,同時需要注射加強針。BNT162b2和mRNA-1273分別在30 μg和100 μg下成功預防了95%新冠感染。而CVnCOV正在進行劑量為12 μg的III期臨牀試驗。
11. mRNA作為佐劑使用
如上所述,RNA本身即具有免疫激活功能。作為RNA固有免疫原性的補充或者替代,有些研究團隊已經在疫苗中添加了某些刺激分子,增強機體對編碼抗原的免疫反應,這種方法已經有部分成功案例。
CureVac公司的CV8102產品中使用了一種非編碼無帽單鏈RNA與陽離子肽載體複合物增強狂犬疫苗的免疫原性。CureVac公司的RNActive疫苗技術平台來源於已經停產CV7201疫苗。該平台依賴於一種雙組分mRNA疫苗,其中裸露的mRNA用於抗原表達,而與魚精蛋白組成複合物的同一種mRNA是激活TLR7和TLR8信號通路的佐劑。TLR信號刺激信號可以導致固有免疫的DC細胞對魚精蛋白響應激活。
然而,在mRNA疫苗中佐劑用處不大。BNT162b2和mRNA-1273僅需要mRNA-LNP製劑,而不需使用佐劑;目前,絕大多數臨牀試驗階段的mRNA疫苗都遵循沒有佐劑的原則。這可能是由於LNP組成本身就可以刺激免疫系統的特定通路,如干擾素基因刺激蛋白(STING)信號通路以及固有免疫的TLR-維甲酸誘導基因I樣受體(RLR)非依賴性介體。
納米制劑既能將mRNA遞送至特定的細胞靶標,又能通過合理的設計實現免疫系統特異性激活,這是mRNA用於疫苗的優勢。
12. mRNA疫苗的副作用
由於疫苗本身預防性、非治療性的特性,對傳染病疫苗需要較高的安全性與耐受性標準。疫苗局部注射疼痛、局部或全身炎症(發熱、不適)是接種疫苗後最常見的不良反應。
兩款新冠mRNA疫苗已在超過300 000例健康受試者(含老年人羣)中接種,可以很好地用於評估疫苗的不良反應。需要強調的是,BNT162b2(30 μg)和mRNA-1272(100 μg)之間除了存在約3倍的劑量差異之外,還需要考慮由此產生的mRNA和脂質注射的差異。臨牀試驗中,可以用納入/排除標準剔除某些高風險人羣(如有既往過敏史患者),因此數據不能完全代表需要保護人羣的結果。
在BNT162b2和mRNA-1273的III期臨牀試驗中,超過80%的疫苗接種者報吿出現了局部不良反應,主要是疼痛。全身不良反應主要是頭痛、疲勞、發燒、肌痛和關節痛。對mRNA-1273,在加強針後出現不良反應的頻率和嚴重程度會更明顯。由於在III期臨牀中的安慰劑是生理鹽水(而不是裸露的mRNA或空白LNP),目前尚不確定是mRNA和LNP中的哪一種引發了這些不良反應。


