前有第六款國產PD-1擊穿“地板價”,後有美國FDA勸退Agenus,在競爭日益激烈的PD-1賽道,中國市場正大打價格戰,而美國市場則在控制賽道參與者數量。這些現象均在告訴業界和投資者,全球PD-1賽道“內卷”,似乎已進入白熱化階段。
以國內市場爲例,從2018年底第1款國產PD-1抑制劑特瑞普利單抗上市至今,國內已有2款進口、6款國產PD-1藥物,並且這一數量還在持續增多。據藥審中心數據,截至今年9月,其已受理276件PD-1的註冊申請,共有42個申報企業。而據西南證券預測,預計未來2-3年內國內上市的PD-1單抗將達到15個。賽道趨於擁擠,產品價格不斷壓低,加之新一輪國家醫保談判臨近,導致市場對於PD-1賽道競爭前景並不樂觀。
但這似乎沒有澆滅各大企業參與PD-1賽道的熱情。
從研發角度來看,關於PD-1 靶點探索成熟度較高,與其他創新生物藥相比,企業研發投入較小、研發風險低、產品生產成本可控,綜合研產銷效率優勢十分明顯。
從市場角度來看,2018年全球PD-1/L1抑制劑的市場規模爲163億美元,到2023年預計將達639億美元。而在中國,預計2023年PD-1/L1抑制劑的市場規模將達664億元人民幣,2030年將增長至988億元人民幣。
由於PD-1產品可以與化療藥物、ADC藥物等多種藥物聯用,並起到“1+1>2”的效果,因此,若將PD-1產品看作是基石類藥物後,單藥和聯合用藥在不同適應症上的應用,以及新的腫瘤免疫產品的開發都可能直接導致這個市場再次擴大。
研發和市場層面的雙重“誘導”,驅使越來越多的藥企開始扎堆PD-1,企圖在這千億市場分一杯羹,而這也讓企業在研發、商業化進度以及適應症覆蓋程度上取得的先發優勢顯得格外重要。
PD-1逃不脫“普藥命運”?
10月26日,禮來發布三季度財報,披露了與信達生物商業化合作的信迪利單抗三季度銷售業績。數據顯示,該產品Q3季度銷售額爲1.26億美元,前三季度銷售額3.4億美元,約合21.7億元人民幣,同比增幅65%。
如果信迪利單抗在今年第四季度能繼續保持穩健增長的銷售態勢,其全年銷售額或將超過30億元人民幣,成爲國內第2款年銷售額突破30億大關的PD-1產品。
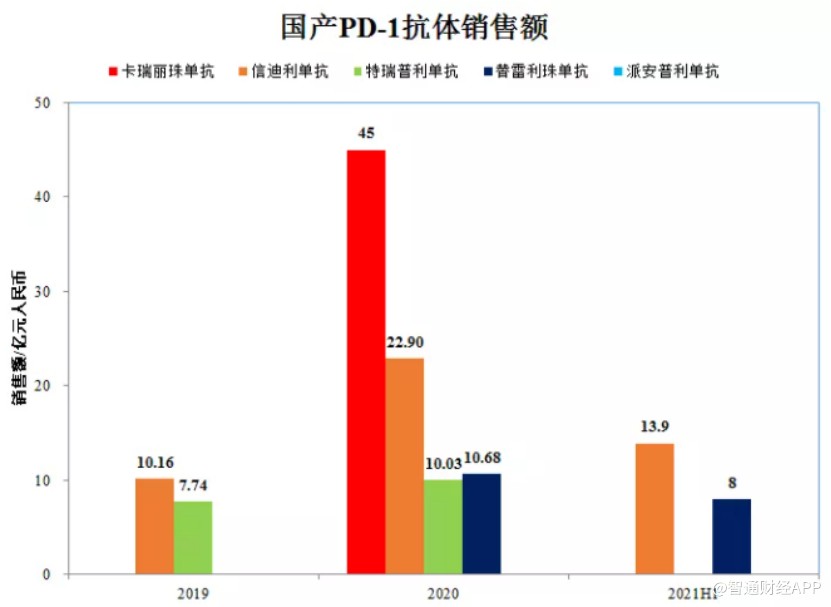
作爲2019年唯一一款被列入國家藥品醫保報銷目錄的PD-1抑制劑,信達生物的信迪利單抗以64%降幅成功進入醫保目錄,年費用由談判前的28萬元降到9.67萬元/年。雖然進入醫保後產品年費用大降,但信迪利單抗仍抓住了賽道競爭白熱化之前的最後機會,實現了在非小細胞肺癌、肝癌等大癌種市場的快速放量,在市場價格戰打響前取得了顯著的業績。
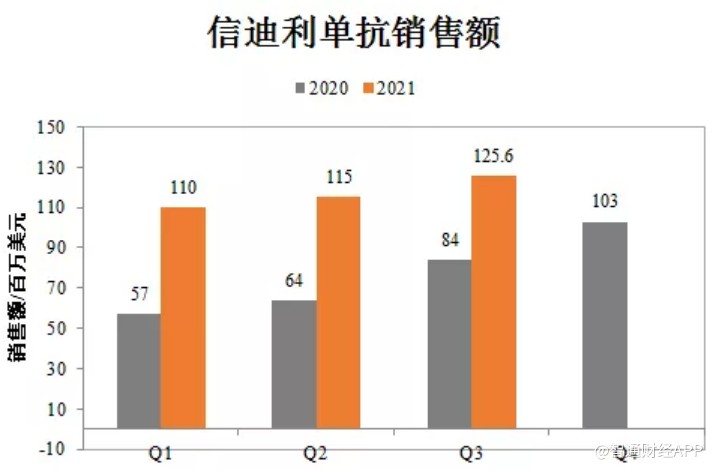
也正是憑藉在2020年的醫保渠道空窗期的大力擴張以及在2021年的持續放量,信迪利單抗才得以在一衆PD-1產品前一騎絕塵。
2020年,恆瑞醫藥、百濟神州、君實生物的PD-1藥物再以平均78%的降幅全部納入醫保,年治療費用直接降到5萬元/年。而隨着獲批上市的產品越來越多,國內PD-1的價格還在持續下降,PD-1/L1單抗有淪爲“普藥”的趨勢。
以獲批較晚的賽帕利單抗爲例,其定價爲3300元/支(120mg),年治療費用爲8.6萬元。但相較之下,信迪利單抗醫保後定價僅爲2843元/支(100mg),並且信達生物還進一步推出贈藥方案。根據新的贈藥方案,符合條件的患者只需自費7個週期,便享有2年的使用權益,整體費用爲3.98萬元,年治療費用不到2萬元。
這就意味着包括賽帕利單抗在內的後續獲批上市的PD-1產品,若定價過高或將失去參與市場競爭的可能。並且由於新玩家”賽帕利單抗以價格3300元一支入場,雖然其已與即將開展的新一輪國家醫保談判失之交臂,但持續降低的產品定價或會影響今年PD-1藥物醫保談判的底價測算,爲後續市場競爭帶來更大壓力。
據東吳證券預計,今年PD-1或將降價至3.5萬元/年的水平,更甚可能低至3萬元,而目前醫保內的PD-1年費用在4-7萬元不等。在此趨勢下,PD-1從“神藥”淪爲“普藥”只是時間問題。
靠小適應症開發走捷徑難度提升
當價格低到不再“內卷”,適應症的覆蓋程度與產能擴張便會成爲新的競爭維度。相比於國內,國外在適應症覆蓋方面的競爭顯得更加激烈。
10月22日,Agenus宣佈“自願”撤回其PD-1單抗balstilimab用於化療後疾病進展的復發或轉移性宮頸癌患者的上市申請,原因在於該適應症已經有K藥先一步申請獲批,兩者療效類似而被FDA建議撤回。而數據顯示,在PD-1領域,K藥的臨牀試驗登記已經超過千條。
不難看到,在FDA審評趨嚴的環境下,具有市場優勢地位的大藥企會在適應症覆蓋上取得更大的先發優勢。
對於另闢蹊徑希望靠小適應症加速批準上市的企業而言,若不能在小適應症研發上取得更顯著的有效證實產品的臨牀益處,彎道超車的可能性便會大幅降低。此次balstilimab加速批準窗口關閉的另一關鍵原因便在於,其在申報的宮頸癌適應症上,20%的ORR並沒有比K藥14%的ORR有顯著的有效性優勢。
回到國內市場,擴大適應症覆蓋面是頭部企業取得市場先發優勢後首要做的工作。
以特瑞普利單抗爲例,作爲四款最先進入醫保的國產PD-1抑制劑之一,特瑞普利單抗除了覆蓋二線治療黑色素瘤、三線治療鼻咽癌和二線治療尿路上皮癌等三項獲批上市的適應症外,還在申請非小細胞肺癌一線治療適應症和一線治療食管鱗癌適應症治療的上市許可。
此外,在國際化方面,特瑞普利單抗目前已經針對鼻咽癌適應症向FDA提交了上市申請,軟組織肉瘤、黑色素瘤等多個適應症也已經獲得了FDA的孤兒藥資格認定。目前在中美等國,特瑞普利單抗的臨牀試驗項目已經超過30項。
實際上特瑞普利單抗僅僅是國內頭部PD-1產品搶佔多適應症市場的一個縮影。上文提到的信迪利單抗,目前也正在進行超過20項的臨牀試驗,包括10項已經註冊的重點臨牀試驗項目,以評估其在多類癌症適應症中的安全性和有效性。
隨着國內PD-1市場競爭趨於白熱化,不難預見,未來CDE對PD-1的審批也將趨嚴。而僅憑藉小適應症進行單臂試驗上市的策略或被頭部企業持續的適應症覆蓋“堵死”。屆時,PD-1市場的“蛋糕分配”也將更趨於兩極化。




