首家A股、港股、美股三地上市醫藥企業即將出現。7月28日晚間,創新生物製藥領域的標杆企業百濟神州提交了科創板IPO註冊稿,或將成為首家A+H+N“三地上市”的藥企。百濟神州創立於2010年,並在2016年成功在納斯達克上市,兩年後又成功登陸港交所,而今又即將科創板上市。短短十一年,百濟神州已從一家初創公司成長為創新藥領域的龍頭企業。
而吸引了眾多投資者關注的百濟神州(6160.HK/BGNE.US),近日公佈了2021年二季度及上半年的業績情況。我們通過此次業績來看一下,百濟神州上半年的發展走勢。
商業化進程加快,上半年產品收入同比增長108%
據百濟神州財報顯示,公司2021年第二季度產品收入約9億元人民幣,相較去年同期大增111%,上半年產品總收入達15.74億元人民幣,同比增長108%。
今年上半年,百濟神州的商業化進程明顯加快,多款新產品、新適應症獲批上市,銷售額不斷增長。百澤安®、百悦澤®、安加維®三款產品五項適應症正式在新醫保目錄中生效後的首個完整銷售季度,銷售額均取得優異成績,自第二季度醫院進院數量顯著增加,分別達到納入醫保前的約13倍、28倍和23倍。
2021上半年,公司共計獲得收入約48億元人民幣,其中產品收入淨額部分15.74億元人民幣,同比增長108%;研發費用43.52億元人民幣,同比增長14.66%。
圖表1:2016-2021百濟神州收入概況
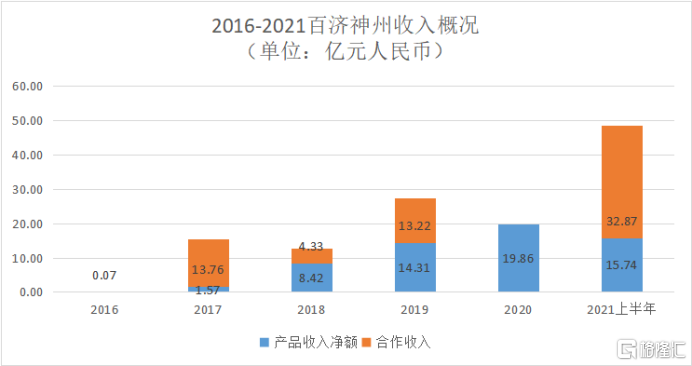
數據來源:公司公吿,格隆彙整理
從產品管線來看,百濟神州在中國新添五項適應症和兩款新產品獲批上市,同時公司的商業化產品及臨牀階段候選藥物達到47款,其中包括9款商業化階段藥物,3款已申報候選藥物和35款臨牀階段候選藥物。此外,公司還有數十款臨牀前在研產品,如此規模的管線儲備是其他公司難以企及的。
圖表2:百濟神州產品管線

數據來源:公司資料,格隆彙整理
從公司主要產品來看百濟神州上半年的研發和經營狀況,其商業化進程和適應症獲批速度明顯加快,公司的商業化能力正在不斷強化。
百澤安®:上半年3大適應症獲批,銷售額同比增長148%
百澤安®(替雷利珠單抗):一款設計旨在避免與巨噬細胞中Fc受體結合、針對免疫檢查點受體PD-1的人源化IgG4單克隆抗體。上半年已獲得NMPA批准3項適應症,包括用於晚期非鱗狀非小細胞肺癌(NSCLC)患者的一線治療和治療至少經過一種全身治療的肝細胞癌(HCC)患者。
圖表3:百澤安®(替雷利珠單抗)
圖片來源:公司官網,格隆彙整理
百澤安®第二季度銷量4.8億元人民幣,上半年銷售額約8億元人民幣,同比增長148%,這是其進入新醫保目錄以來的第一個完整銷售季度,對比同類產品同階段的數據,2020年1月進入新醫保目錄的PD-1產品,其第一個完整銷售季度的銷售額為4億人民幣,百澤安®作為國內第7款上市的PD-1/PD-L1產品,在醫保目錄中有3款同類競品的激烈競爭環境下,仍取得如此優秀的銷售成績,可謂是表現不俗。
同時,隨着百濟神州2021年1月與諾華的戰略合作正式生效,諾華將在美國、加拿大、墨西哥、歐盟成員國、英國、挪威、瑞士、冰島、列支敦斯登、俄羅斯和日本開發、生產和商業化抗PD-1抗體百澤安®(替雷利珠單抗),預計年內PD-1也將提交海外的上市申請。
百悦澤®:上半年同比增長737%,全球新增5項新藥或適應症申請獲批
百悦澤®(澤布替尼)是一款由百濟神州科學家自主研發的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,於2019年首次在美獲批上市,目前在多個國家共有9項新藥或適應症申請獲批,此外共有30多項針對多項適應症的相關上市申請完成遞交工作,覆蓋美國、歐盟以及其他20多個國家或地區。
圖表4:百悦澤®(澤布替尼)

圖片來源:公司官網,格隆彙整理
作為百悦澤®進入新醫保目錄的首個完整銷售季度,其第二季度全球銷量約2.7億元人民幣,上半年銷售額超4億元人民幣,同比增長737%,對比全球第二款上市的BTK抑制劑Acalabrutinib,在其上市的第二年,2019年第一季度其銷售額約為1.86億元人民幣,第二季度銷售額約為2.25億元人民幣,而百悦澤®作為全球第三款上市的BTK抑制劑,放量速度旗鼓相當,也展現了其在全球市場的發展潛力。隨着海外商業化佈局的拓展,包括在阿聯酋、以色列、智利等國際市場獲批上市,百悦澤®的全球銷售額正穩健成長。
公司還將繼續推進百悦澤®在全球新的地區擴展新的適應症,有望於2021年在中東、南美、澳大利亞和俄羅斯獲批用於治療MCL患者,在歐盟和澳大利亞獲批用於治療WM患者。
在第二季度已公佈的全球3期SEQUOIA試驗期中分析的積極結果中,與B+R(百悦澤®與苯達莫司汀聯合利妥昔單抗)聯合療法相比,百悦澤®的PFS方面也顯示了具有統計學顯著性的改善,同時該研究中百悦澤®耐受良好,符合已知的安全性特徵。
而在另一項頭對頭全球3期ALPINE研究的期中分析裏,百悦澤®也取得了積極結果,ALPINE試驗顯示,對比第一代BTK抑制劑伊布替尼,百悦澤®用於治療復發或難治性(R/R)慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)的成年患者時,在研究主要終點,即研究者評估的總緩解率(ORR),和關鍵次要終點房顫或房撲事件率方面均顯示出了優效性。
這兩項試驗可謂是百悦澤®在全球市場中的重要一役,通過大型的全球3期臨牀,證實其在CLL這一關鍵適應症領域中的治療地位和優越性,結合公司成熟的全球化商業能力,將能夠幫助百悦澤®在全球BTK市場取得更大的市場份額。
百匯澤®:新藥獲批上市,商業化進程不斷加快
百匯澤®(帕米帕利)是一款PARP1和PARP2的選擇性小分子抑制劑,目前已經在中國獲得附條件批准用於既往接受過至少兩線化療、伴有胚系BRCA(gBRCA)突變的晚期卵巢癌、輸卵管癌或原發性腹膜癌患者。
作為百濟神州的第三款自主研發藥物,百匯澤®於2021年5月在中國上市銷售,截至2021年6月30日前三個月內,其中國銷售收入約為1414.6萬元人民幣,值得注意的是,百匯澤®在獲批後僅3天就以完成商業化供貨,並開出首張處方,可見公司的商業化速度和成熟的渠道能力。
國際化佈局快馬加鞭,研發進程不斷加速
除了三大自主研發的已上市的藥物,百濟神州其他產品同樣取得了不錯的成績。
凱洛斯®(KYPROLIS®,注射用卡非佐米)已獲得NMPA附條件批准與地塞米松聯合適用於治療復發或難治性(R/R)多發性骨髓瘤(MM)成人患者。
作為新納入新醫保目錄的三款產品之一,百濟神州首款授權引入藥物安加維®在中國的上半年銷售收入為1.15億元。
除此之外,百濟神州多項產品已經或正在進入關鍵性臨牀階段。包括後續產品管線中,一款具有強效Fc功能的在研TIGIT單克隆抗體Ociperlimab (BGB-A1217),已啟動兩項針對NSCLC的全球3期臨牀試驗,是當前全球TIGIT賽道的競爭中,處於領先地位的產品之一,將聯合PD-1,持續探索免疫腫瘤聯合療法潛力。
值得注意的是,在生產運營方面,百濟神州也取得了較大突破。其廣州生物藥生產基地已於4月獲批用於開展抗PD-1抗體百澤安®(替雷利珠單抗)的商業化生產。另外蘇州小分子創新藥物產業化基地項目正式啟動奠基,預計2023年完成建設,建設完成後,公司現有的小分子藥物總產能預計將擴大十倍,將能夠充分滿足未來更多商業化產品持續的供應需求。
此外,基於公司的國際化佈局,百濟神州已在新澤西州霍普韋爾(Hopewell)的普林斯頓西部創新園區收購場地,用於建設新的生產和臨牀研發中心,以擴充公司在全球的自主生產供應能力,該基地預計於2023年建成。
小結
從商業化能力來看,百濟神州自主研發能力的價值不斷凸顯,同時通過和諾華等大型國際藥企進行的全球戰略合作,正在進一步兑現和印證公司的商業化能力,通過將市場拓展至全球,為後續增長提供了強大保障。
從研發和獲批速度來看,公司已逐步進入收穫期,大量適應症的快速獲批為公司的盈利不斷提供新的增長點,通過在前端管線佈局中打造一個龐大的在研管線,從而帶來持續不斷的產品輸出,其儲備的大量臨牀階段候選藥物,也將在未來具備較強的變現能力。
總的來説,作為創新生物製藥的龍頭企業,同時也是有望成為首家A+H+N三地上市的醫藥企業,百濟神州產品銷售收入快速增長,公司在商業化思路上的正確性正在得到驗證,而其在全球範圍的全產業價值鏈能力,也為公司成為一家綜合性的全球大型生物製藥企業奠定基礎,相信在創新藥企全球化佈局的浪潮中,百濟神州有望給業界帶來新的期待和驚喜。
注:參考匯率為6.43元人民幣/美元


