作者 | 東北一度
數據支持 | 勾股大數據(www.gogudata.com)

新冠疫情的持續凸顯了疫苗的重要性以及全球對疫苗的迫切需求。藉此契機,mRNA疫苗登上了舞台。mRNA疫苗運用場景不僅限於傳染病預防,在治療腫瘤、免疫疾病等領域具有令人期待的發展空間。
mRNA疫苗作為最新一代技術,包括沃森生物、復星醫藥、智飛生物在內的眾多企業通過不同途徑進行了佈局;mRNA疫苗因其顛覆傳統免疫激活路徑,提供穩定高保護率和不錯的安全性,深受市場關注。
1
mRNA疫苗治療原理
mRNA疫苗是一種核酸疫苗,通過將病毒的部分mRNA片段注入人體細胞內產生抗原,再由此激發特異性免疫反應,達到形成免疫記憶的效果。
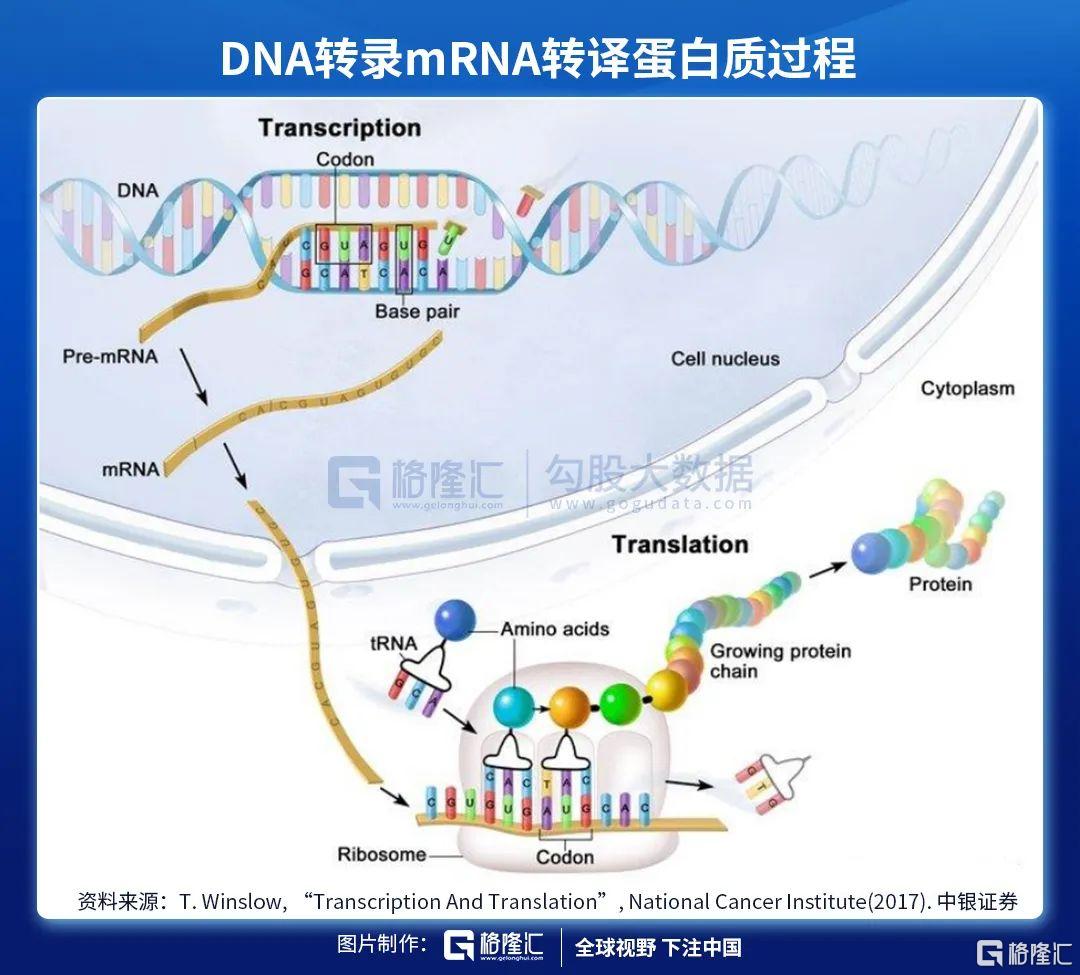
DNA是存儲人體遺傳信息的載體。人體內絕大部分細胞都帶有DNA。但是DNA本身無法直接對人體產生影響,各類蛋白質才是能夠左右表象的物質(例如:抗原、激素)。DNA需要轉化為蛋白質才能夠將遺傳信息表達出來。
整個DNA轉化為蛋白質的過程分為兩大步,第一步:DNA轉化為mRNA,這一步驟稱為轉錄(transcription),發生在細胞核內;第二步:mRNA轉化為蛋白質,這一步驟稱為轉譯(translation),發生在細胞質中。
具體來分析mRNA新冠疫苗的機理。mRNA疫苗中的mRNA片段編碼新冠病毒表面的某些蛋白或受體,例如刺突蛋白(S蛋白)。疫苗遞送人工編輯後的mRNA進入人體細胞,在體內“借用”人體自身細胞轉譯mRNA為蛋白質。
此類mRNA在經過轉譯後會表達成為病毒所具有的某種抗原蛋白。雖然產生的抗原是由自身細胞製造,但由於其氨基酸序列具有外源性,APC中的TLR並不識別此段序列,因此仍舊會激發B細胞和T細胞針對此抗原蛋白的特異性免疫反應,並建立免疫記憶。
2
LNP遞送系統:遞送疫苗有效物質進入預定軌道的運載火箭
mRNA疫苗的生產可分為三大階段,一是DNA原液製備,二是mRNA原液的製備,三是利用脂質微粒進行包封。
如今,病毒遺傳信息序列的解碼和反向序列合成已不是難題。如何將合成好的mRNA序列遞送進入人體細胞變成了mRNA疫苗研發的重要挑戰之一。
人體細胞結構從外至內可分為細胞膜(cell membrane)、細胞質(cytoplasm)、細胞核(nucleus)。mRNA轉譯成蛋白質的過程發生在細胞質中,因此,mRNA疫苗要發揮作用,必須先將編輯好的mRNA轉遞進細胞質中。
進入細胞質需要通過細胞膜,細胞膜由磷脂雙分子層構成,磷脂分子頭部具有親水性,尾部具有疏水性,兩層磷脂尾部相對形成雙分子層,能夠有效控制水分子、離子、大分子物質通過。mRNA作為大分子(300-5000kDa),在不破壞細胞膜的前提下,進出細胞只能以內含體(endosome)通過胞吞作用(endocytosis)。
通常情況下,內含體進入細胞質後,會被直接送至溶酶體(lysosome)進行分解。為保證mRNA在轉譯前保持完整性,mRNA需要在內含體與溶酶體結合前打破內含體包膜(endosomal disruption)並逃離。
逃離內含體進入細胞質後,mRNA便會在細胞質內遊動,直至到達核糖體(ribosome)並在此轉譯為肽鏈,最終摺疊成為蛋白質。
對於mRNA疫苗和藥物,遞送系統有兩大職責:一是有效包裹和保護mRNA在到達靶點前維持穩定,二是幫助mRNA有效成分進入細胞,三是在mRNA到達溶酶體前將其釋放進入細胞質中。
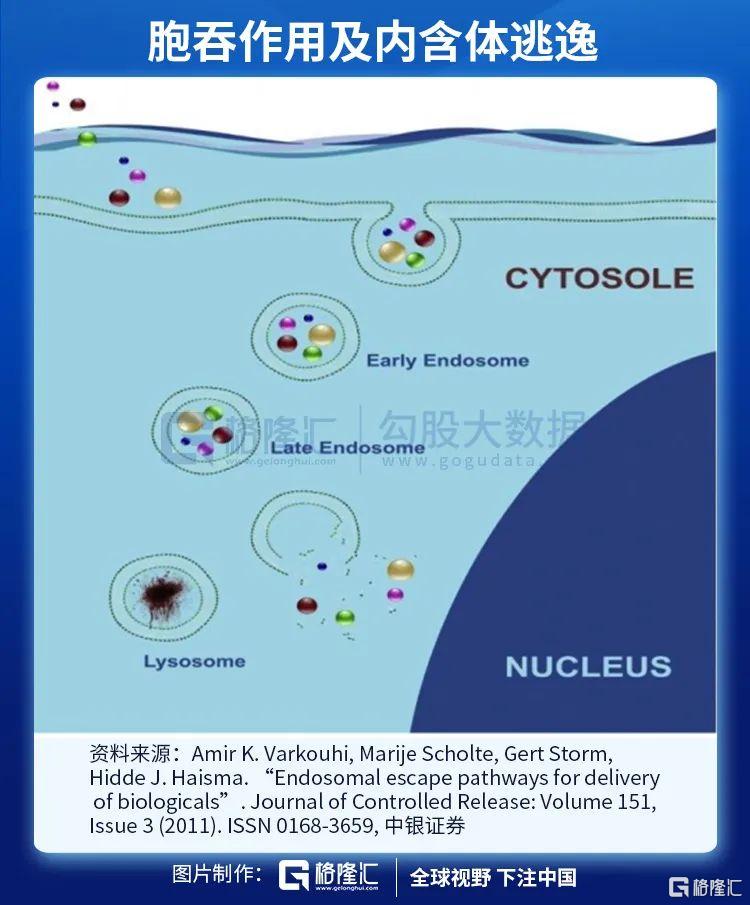
LNP是目前最具潛力的遞送載體之一。LNP(Lipid Nanoparticle)是脂質微粒的總稱,其中又包括脂質膠團(micelle)、脂質體(liposome)等。LNP與細胞膜的組成成分相似,均由脂質分子構成。脂質分子的兩條長尾通常呈平行狀態,在此狀態下,脂質形成的雙分子層穩定。
在進入細胞質酸性環境後,部分脂質的頭部質子化,呈現陽離子形態,與其他陰性離子態的脂質分子相吸引,尾部張開。原本雙分子層的形式被破壞,形成頭部聚集在一起的環狀。之前包裹在內的mRNA便可逃逸出內含體,進入細胞質等待轉譯。
3
mRNA疫苗相較於其他技術路徑疫苗的優劣勢分析
mRNA疫苗 vs. 滅活疫苗
與傳統滅活疫苗、裂解疫苗相比,mRNA疫苗激活特異免疫的路徑不相同。傳統疫苗激活特異性免疫的方式是直接將抗原蛋白注射進入人體,引起免疫反應;而mRNA是將編碼病毒抗原的mRNA注入體內,由人體自身細胞產生對應的抗原,以此激活特異性免疫。
理論分析,mRNA疫苗能夠呈現更多的抗原,同時能更持久地激活鞏固特異性免疫。原因在於,傳統滅活疫苗的抗原呈遞數量是一定的,即最終到達體內引起免疫反應的抗原數量只能夠小於或等於疫苗中含有的抗原數量。
同時,滅活疫苗呈遞抗原的過程是一次性的,注射時疫苗呈遞的抗原即為所有抗原,這些抗原的降解時長即為持續激活免疫的時長,此後不會有新增抗原。
而mRNA疫苗抗原呈遞的過程是可短暫持續的,呈遞的mRNA可指導多個核糖體產生抗原蛋白,直至mRNA 降解。由於細胞能夠不斷根據mRNA生產抗原蛋白,因此抗原數量受疫苗劑量所限制較小,從時間維度上看,抗原不會在短時間內迅速被消耗完畢。抗原數量水平越高、保持時長越長,形成的特異性免疫記憶越強烈,免疫應答更快、持續時間越長。
mRNA疫苗 vs. DNA疫苗:更高效,逆轉錄風險較小
與核酸疫苗中另一路徑的DNA疫苗相比,mRNA疫苗更有效也更安全。DNA疫苗需要將包裹的有效成分遞送通過兩層屏障:細胞膜和細胞核膜,最終進入細胞核內開始抗原蛋白的表達。多層屏障導致有效成分難以進入反應場所,免疫激活更難。
同時,由於DNA疫苗呈遞的有效成分需要進入細胞核內,導致外源遺傳片段逆轉錄進入人體DNA的概率增加,引起腫瘤癌症的概率增加。相較而言,由於mRNA疫苗導入的外源物質不需進入細胞核,發生外源遺傳片段逆轉錄進入人體自身DNA的概率較小,因此引起腫瘤癌症的概率極小。
mRNA疫苗 vs. 病毒載體疫苗
另一大受到較高關注度的載體平台是病毒載體平台,常見的類別有腺病毒(Adenovirus)、腺相關病毒(Adeno-Associated Virus,AAV)、慢病毒(lentivirus)。病毒載體通過去除病毒本身的有害物質,保留感染能力,將目標物質遞送進入細胞內,由細胞產生抗原蛋白,進而引起特異性免疫反應。
病毒載體反應的一大缺陷是,若接種者本身體內含有針對此病毒載體的抗體(如腺病毒、AAV、慢病毒,而非針對目標抗原的抗體),或在短時間內快速產生了抗體,則病毒載體疫苗無法將有效成分遞送進入預定的細胞質內。
相比之下,LNP的結構由脂質分子構成,載體引起免疫反應的機率較小,能夠更有效地遞送有效成分至目標靶點。除此之外,部分病毒平台有發生逆轉錄的概率,會將外源基因整合進入人體DNA中,可能導致腫瘤、免疫疾病等。
同時,病毒載體疫苗具有更高的機會成本。當人體接受病毒載體疫苗注射後,體內會自動產生針對此載體的抗體和其他特異免疫反應。此後再次運用相同或相似病毒載體作為遞送系統給藥時(例如一些腫瘤治療藥物),會更容易遭到免疫系統的攻擊,難以成功將藥物遞送至靶點。
mRNA疫苗的臨牀運用歷史始於2020年新冠疫情。根據WHO數據,截止2021年5月7日,全球共有15款mRNA疫苗在研,其中包括已納入WHO緊急使用名單(Emergency Use Listing,EUL)的2款mRNA疫苗:由輝瑞/BioNTech聯合研發的BNT162b2,以及由Moderna研發的mRNA-1273。
2020年11月18日,輝瑞發佈了BNT162b2的III期臨牀試驗結果,結果顯示疫苗整體保護率高達95%。2021年3月31日,Moderna發佈了mRNA-1273的III期臨牀試驗結果,結果顯示疫苗整體保護率也達到94.1%,與BNT162b2的數據非常接近。
除了有效保護率外,疫苗的另一重要指標是不良反應發生的種類和概率。總體來説,滅活疫苗因其成熟的技術和研發生產經驗,不良反應發生頻率較低,反應程度也較為温和。mRNA疫苗則運用了全新的技術,目前得到的安全數據只反映了接種後短期內可能發生的不良反應,是否會對人體造成長期的影響還需要時間進行長期的觀察。
臨牀實驗數據顯示,mRNA疫苗的各項不良反應發生率都較為明顯地高出滅活疫苗對應水平,會讓接種者在短期內產生更多的不適感。但在臨牀試驗中並未出現嚴重甚至致命性的不良反應。
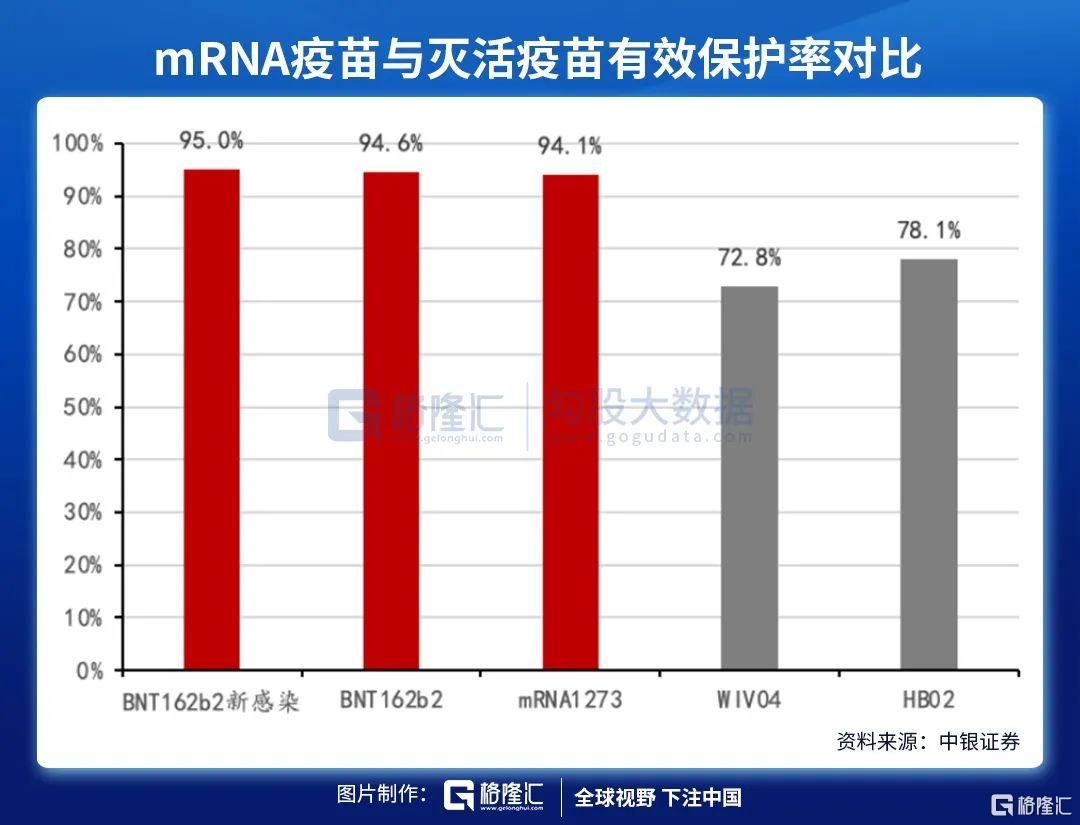
注:從左至右分別為BNT162b2對從未感染過新冠病毒人羣的保護率,BNT162b2整體保護率,mRNA1273整體保護率,國藥/武漢滅活疫苗整體保護率,國藥/北京滅活疫苗整體保護率。
4
國內mRNA疫苗標的
截至2021年7月16日,全球已經接種疫苗約35.8億劑,接種率為45.87%;其中中國接種量14.3億劑,接種率99.1%;美國接種量3.36億劑,接種率為100.48%。全球主要國家中接種率最高的為英國,接種率為120.35%。
短期內,國內新冠疫苗市場已被傳統的滅活疫苗佔據。目前已有6家企業的新冠疫苗可在國內銷售,其中北生所、武漢所、科興、康希諾是有條件批准,智飛生物和康泰生物是緊急使用。
長期來看,新冠的大範圍傳播增加了病毒變異的可能性。現有疫苗能否防範變異病毒成為社會關心的熱點之一。普通羣眾對疫苗有效性感到擔憂,投資者則關心是否會影響現有疫苗的放量情況。針對這一問題,mRNA疫苗效力遭到削弱的幅度有限,而對於傳統滅活疫苗將會是一個嚴峻挑戰。
由於滅活疫苗的保護器為6個月,截至2021年12月10日左右將有超過2億人需要第二輪新冠疫苗接種。根據2021年6月10日數據,截至當日接種了一劑次的人數為3.984億人,這一部分羣體在2021年7月10日前將接種第二劑次,並且在2022年1月10日前開始進行第二輪的接種,屆時國內市場將有約4億劑次的新需求。這為mRNA疫苗提供了極大的機會。
國內暫未有mRNA獲批上市,這一市場目前仍處於空白狀態。在第二輪新冠疫苗需求到來之際,國產mRNA疫苗的競爭將會打響。
目前國內市場中,mRNA疫苗研發進展最快的是艾博生物與沃森生物、軍科院共同研發的ARCoV,以及復星醫藥由BioNTech引進的BNT162b2。
沃森生物
2020年5月11日,沃森生物公吿與蘇州艾博生物簽署關於新冠mRNA疫苗的合作協議。艾博生物具有mRNA疫苗設計的核心技術,其CEO英博先生曾供職於國際mRNA疫苗巨頭Moderna。沃森生物則擁有臨牀註冊、研究、產業化和營銷方面的豐富經驗。今年5月,墨西哥宣佈將在5月底開展此疫苗的III期臨牀試驗。
聚焦前沿技術,提前佈局新一代核酸類藥物。4月27日,上市公司與聖諾生物簽署了抗病毒核酸干擾藥物的合作協議。聖諾生物負責完成藥物的臨牀申報所需的臨牀前研究,公司獲得該藥物在中國大陸及港澳台地區的獨家權利。
13價肺炎疫苗開始貢獻收入,國際化銷售錦上添花。2021Q1沃森生物子公司13價肺炎疫苗獲批簽發164.3萬瓶,達到2020年全年批簽發量的36.8%。同時,子公司與摩洛哥MarocVax達成排他性協議。MarocVax保證在收到完整產品註冊檔案後18個月內獲得上市許可。2021年,此疫苗於摩洛哥的銷量約為200萬劑。技術轉移後,MarocVax將繼續採購至少等同於200萬劑的疫苗原液。
根據券商一致預測,沃森生物預計21-23淨利潤13億、18億、26億。
復星醫藥
7 月 14 日,復星醫藥在股東大會上回復投資者問詢時表示,藥監局對 mRNA 新冠疫苗“復必泰”的審定工作已基本完成,專家評審已通過,處於行政審批階段,復星醫藥已與 BioNTech 提前啟動生產準備工作,有望成為國內首個獲批的新冠mRNA疫苗。
今年5月9日,公司公吿子公司復星醫藥產業與BioNTech設立合資公司,以實現mRNA新冠疫苗產品的本地化生產及商業化。雙方分別認繳合資公司註冊資本的50%,BioNTech以技術和許可等無形資產方式出資。復星醫藥產業應提供產能可達10億劑的生產設施。
另外,復星醫藥在CART領域也獲批了國內第一個產品。2021年6月23日,NMPA批准了復星子公司復星凱特的奕凱達的上市申請,用於治療復發難治性大B細胞淋巴瘤。復興凱特在針對中國患者的難治性侵襲性大B細胞淋巴瘤的實驗中ORR達到79.2%,與Yescarta的臨牀和真實世界數據高度相似。2020年Yescarta全球銷售額約6.07億美元,同比增長33%。
復星在創新藥方面持續投入,研發費用率穩定在10%左右,逐步接近國際製藥巨頭水平。阿達木單抗、曲妥珠單抗、CAR-T細胞治療等多個產品已獲批上市,成為公司營收新的增長點。截至2020年末,公司在研創新藥項目達56項,為未來長期發展做好戰略儲備。
根據券商一致預測,復星 2021-2023 年公司淨利潤預計 44 億、 53 億、 61億。
考慮到康希諾生物半年報預吿中50%左右的淨利率,沃森和復星的業績預估都偏保守,值得重點關注。



