攻克癌症是世界醫療史上長久以來的課題,近年來,無數企業相繼研發出各種靶向創新藥,開啟了人類抗爭癌症的新時代。這些藥物不僅為癌症患者帶來了前所未有的治療手段,也觸發了藥企之間創新研發、角逐世界頂尖地位的戰爭。
而擁有同類首創或同類最優產品的公司,成為了最有可能在這場廝殺中成長壯大的企業。基石藥業是一家生物製藥公司,專注於開發及商業化創新腫瘤免疫治療及精準治療藥物。公司以腫瘤免疫治療聯合療法為核心,建立了一條14種腫瘤候選藥物組成的豐富產品管線,其中6款後期候選藥物正處於關鍵性臨牀試驗或註冊階段,其中一項已經獲批。公司擁有多個潛在同類首創或同類最優的創新藥物。
在未來的商業化賽跑中,基石藥業非常具有看點。
圖表一:基石藥業研發管線

數據來源:公司資料,格隆彙整理
四款產品臨近商業化,基石藥業將迎來收穫期
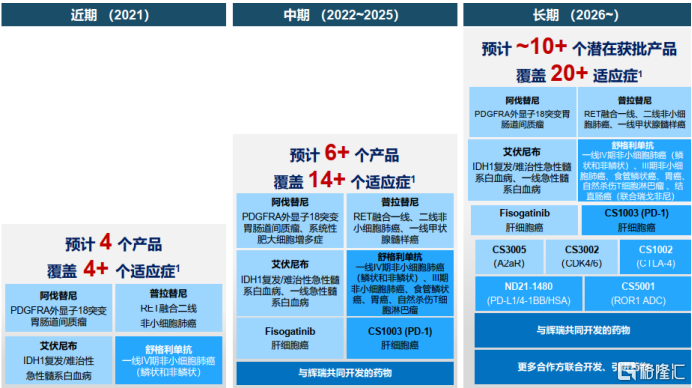
2021年,基石藥業可能將有4款創新藥上市,分別為普拉替尼(RET)、阿伐替尼(KIT/PDGFRA)、艾伏尼布(IDH1)和舒格利單抗(PD-L1抗體),其中普拉替尼的新藥申請於2021年3月24日已獲得中國藥監局批准,阿伐替尼的新藥申請於2021年3月31日也獲得中國藥監局批准。這4款創新藥也是基石藥業多樣化佈局的直接成果,商業化潛力巨大。具體來看:
圖表二:基石藥業顯著的臨牀進展

數據來源:公司資料,格隆彙整理
1、普拉替尼:潛在同類首創RET抑制劑
普拉替尼是一種口服、每日一次、強效高選擇性RET抑制劑,商品名為GAVRETO™。普拉替尼旨在選擇性地和有效地靶向致癌性RET突變,包括可能導致治療耐藥的繼發性RET突變。在臨牀前研究中,普拉替尼抑制RET的濃度低於其他藥物相關激酶,包括VEGFR2、FGFR2和JAK2。
圖表三:普拉替尼的研發進展以及監管審評狀態

數據來源:公司資料,格隆彙整理
目前,美國FDA已批准該款藥物分別用於三個適應症,分別為非小細胞肺癌、甲狀腺髓樣癌以及甲狀腺癌。普拉替尼的適應症二線非小細胞肺癌已於2021年3月24日在中國大陸獲批,預計於2021年在中國台灣地區遞交NDA。這此獲批標誌着中國迎來了首個獲批的RET抑制劑,也標誌着基石藥業迎來了首個商業化產品。
此外,基石藥業還在中國大陸進行了多個臨牀試驗,其中RET突變甲狀腺髓樣癌及RET融合陽性甲狀腺癌的NDA已在今年3月向NMPA遞交,一線及二線RET融合陽性非小細胞肺癌的NDA預計在2021年下半年遞交。同時,基石還在進行“籃式試驗”,針對結直腸癌、胃癌等多個適應症,這些豐富且全面的研究將進一步擴大普拉替尼的市場。
另外,Blueprint Medicines和羅氏正在全球(不包括大中華地區)共同開發普拉替尼,用於治療RET突變的非小細胞肺癌、各類甲狀腺癌以及其他實體瘤患者。2020年,羅氏擁有了普拉替尼的在美國權利的50%,外加除美國與大中華地區外的全球權利。交易價格包括:(1)17億美元的預付款及里程碑付款;(2)除美國之外的銷售收入的特許權使用費;(3)美國地區50%的銷售利潤。(即17億=普拉替尼全部價值-50%美國價值-大中華區價值)。由此可以估算,基石藥業擁有的大中華區價值至少值5-6億美元。對比公司目前估值可見,基石藥業存在較為明顯的低估,未來增長空間可觀。
2、阿伐替尼:潛在全球同類首創KIT/PDGFRA抑制劑
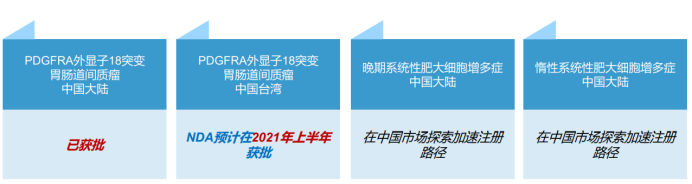
阿伐替尼是一種激酶抑制劑,商品名為AYVAKIT™,用於治療攜帶PDGFRA外顯子18突變(包括PDGFRAD842V突變)的不可切除或轉移性胃腸道間質瘤(GIST)成人患者。
目前,歐盟委員會已批准阿伐替尼以商品名AYVAKYT®上市銷售,美國FDA已授予阿伐替尼突破性療法認定。中國大陸地區,PDGFRA外顯子18突變胃腸道間質瘤適應症的NDA已於2021年3月31日獲得中國藥監局批准,中國台灣地區NDA於2020年也已遞交,預計2021年上半年獲批。
圖表四:阿伐替尼的研發進展以及監管審評狀態
數據來源:公司資料,格隆彙整理
在美國和歐洲,該藥是第一個適用於治療基因組定義的GIST患者的精準治療藥物,也是唯一一款針對攜帶PDGFRA基因18號外顯子突變GIST患者的高活性療法,有望成為國內首個針對PDGFRA外顯子18突變胃腸道間質瘤的治療方法。另外,基石藥業還在中國市場就晚期系統性肥大細胞增多症(ASM)及惰性系統性肥大細胞增多症(ISM)探索加速註冊路徑。其中基石的合作伙伴Blueprint就ASM的適應症預計今年6月將在美國獲批。我們也看好基石在這一疾病領域的佈局和未來成長空間。
3、艾伏尼布:全球同類首創IDH1抑制劑
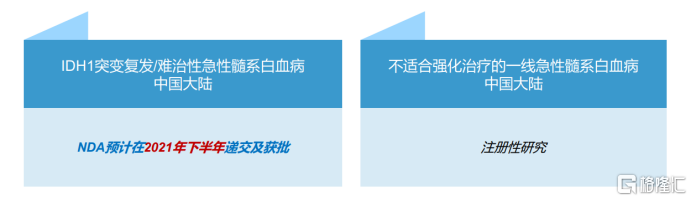
艾伏尼布是一種強效、高選擇性同類首創口服IDH1抑制劑,用於治療經FDA批准的伴隨診斷檢測的攜帶易感IDH1基因突變的急性髓系白血病(AML)成人患者。
美國FDA已經批准了艾伏尼布針對復發/難治性急性髓系白血病和單藥用於不適合強化治療的一線急性髓系白血病的新藥申請。中國大陸也批准了艾伏尼布採用美國NDA數據註冊的新藥申請,並納入中國大陸臨牀急需用藥目錄,意味着加速審批路徑,技術審評不超過70天。此外,該適應症於新加坡的新藥申請也已經遞交。另外基石藥業還在中國大陸進行不適合強化治療的一線急性髓系白血病的研究。
目前,艾伏尼布是全球首個唯一獲得FDA批准治療IDH1突變R/R AML的藥物。
圖表五:艾伏尼布的研發進展以及監管審評狀態
數據來源:公司資料,格隆彙整理
4、舒格利單抗:擁有成為同類最優免疫檢查點抑制劑的潛力
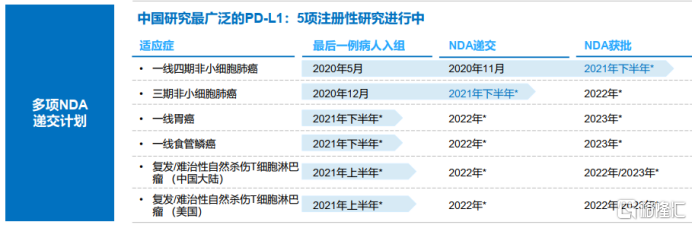
舒格利單抗是由基石藥業開發的全人源全長抗PD-L1單克隆抗體,是一種最接近人體的天然G型免疫球蛋白4(IgG4)單抗藥物。其適應症包含了一線IV期非小細胞肺癌、III期非小細胞肺癌、一線胃癌、一線食管癌和自然殺傷/T細胞淋巴瘤。
其中舒格利單抗治療IV期非小細胞肺癌患者的III期臨牀試驗達已到主要終點,2020年10月,新藥上市申請已經獲得中國國家藥品監督管理局受理,預計2021年下半年獲批。而三期非小細胞肺癌於2020年完成患者入組,預計2021年將在在中國大陸遞交NDA。另外,一線胃癌、一線食管癌和自然殺傷/T細胞淋巴瘤的患者入組也在如期推進。美國食品藥品監督管理局以及NMPA都授予舒格利單抗突破性療法認定用於治療成人R/RENKTL,
在一線治療晚期鱗狀非小細胞肺癌的PD-(L)1中,舒格利單抗以67%的疾病進展或死亡風險的減少,名列諸多同類型在研產品第一。而一線治療晚期非小細胞肺癌的PD-(L)1中,舒格利單抗也以50%的疾病進展或死亡風險減少的數據名列前茅。舒格利單抗是首個在非小細胞肺癌患者(鱗癌及非鱗癌)治療中展現療效的PD-L1,是所有PD- 1 及PD -L1 單抗中的最佳數據之一。隨着三期非小細胞肺癌的推進,舒格利單抗有望成為全球唯一一款同時針對三期及四期非小細胞肺癌的PD-(L)1(若三期非小細胞肺癌試驗到達臨牀終點)。目前,已有超過1,600位患者在舒格利單抗單藥或聯合用藥方案中實現給藥,展現出了優越的安全性,這將成為該藥在未來競爭中的優勢之一。
圖表六:舒格利單抗的研發進展以及監管審評狀態
數據來源:公司資料,格隆彙整理
除我國發病率和死亡率最高的肺癌以外,舒格利單抗還策略性地針對多項中國大型適應症,且在臨牀試驗中表現了出色的抗腫瘤活性,研發進度也為國內PD-L1單抗的第一梯隊。未來實現商業化之後,舒格利單抗或將憑藉廣泛的適應症、優異的安全性以及出色的抗腫瘤活性成為市場上的重磅PD-L1產品。
產品管線邁入2.0時代,將同類首創/同類最佳進行到底
進入2021年,公司將繼續推進管線2.0發展,聚焦於多個同類首創/同類最佳的分子,達成全面成熟商業化機構的清晰戰略,實現近期的規模效應目標。到2021年末,基石藥業將共計開展30項臨牀試驗,其中包括15項註冊性臨牀試驗。在創新研發最受關注的多特異性抗體以及抗體藥物偶聯物上,基石藥業已經為下一代產品積累了兩項同類最佳的產品。
圖表七:基石藥業的管線2.0發展

數據來源:公司資料,格隆彙整理
NM21-1480 (PD-L1x4-1BBxHSA) 銜接新型生物學,能夠在提高療效數據的同時,減少不必要的毒性反應,增加了更多聯合療法的選擇並改善給藥的便利性,具備成為同類最佳的下一代PD-(L)1抗體的潛力。LCB71(ROR1抗體偶聯藥物, ADC)則基於差異化的技術,基石擁有其韓國以外的開發和商業化權利,具備成為同類最佳ROR1抗體偶聯藥物的潛力。
從公司人才隊伍來看,基石藥業核心管理層在行業內均具有20年以上的經驗,曾供職於行業領先的跨國藥企,大多擁有醫學博士學位。強大的自有研發團隊擁有約160名臨牀員工,佔比接近所有員工的30%,其中有約70%擁有碩士及以上學位,並且約70%擁有在大型國際性公司的臨牀研發經驗。
圖表八:基石藥業管理層

數據來源:公司資料,格隆彙整理
核心管理層和研發團隊背景聚焦在腫瘤領域,能力高度互補,職能橫跨研發、生產、註冊、商業化等醫藥創新產業鏈上的各個環節。這將成為基石藥業打造管線2.0,引領全球同類首創/同類最佳產品的創新模式最堅實的基礎。
商業化進程三步走,積極開展戰略合作
基石藥業的商業化規劃分為三步,2020年已經完成了第一階段,公司建成了具備成熟的核心競爭力和商業團隊的商業化機構,還聚焦精準治療,啟動了海南博鰲早期准入計劃精準治療試點工作。第二階段,基石藥業打算通過建立強大的商業平台達到“規模效應”,最終在第三階段達成成為全球知名的中國領先的生物醫藥公司的全球願景。
圖表九:基石藥業商業化路線圖
數據來源:公司資料,格隆彙整理
此外,為了快速推進公司的商業化,基石藥業達成了三個重大的戰略合作項目。其一,公司的舒格利單抗獲得輝瑞的高度認可,並與其達成多維度戰略合作,輝瑞獲得了基石藥業舒格利單抗的中國商業化權力。基石藥業則獲得最高2.8億美元的里程碑付款,以及百分之十幾中高段的分級特許權使用費,保留舒格利單抗大中華區以外權益。這有助於舒格利單抗在中國實現更快速、更廣泛的商業化。
並且,輝瑞還將以每股1.725美元(約13.37港元)價格,認購9.9%的基石藥業股份,認購總額達2億美元。輝瑞將通過股權投資的方式,充分鞏固了與基石藥業之間的長期合作關係,這有利於讓公司極富競爭力的平台進一步推進授權引進交易,快速擴張產品管線。
其二,基石藥業還得到頂級生物科技公司EQRx的青睞並與其達成高額授權協議。在此協議中,基石藥業授權EQRx在大中華區以外地區開發及商業化兩款處於後期研發階段的腫瘤免疫治療藥物——舒格利單抗(CS1001, 抗PD-L1抗體)和CS1003(抗PD-1抗體),獲得了1.5億美元預付款,最高可達11.5億美元的里程碑付款,以及分級特權使用費。
這次合作最大化了公司兩個領先腫瘤免疫治療藥物的全球商業化潛力,讓公司即刻獲得巨大財務收益。體現了公司建立全球合作伙伴關係的卓越能力,對全球癌症患者也具有重大意義。
其三,基石藥業通過與LegoChem Biosciences的全球授權協議,獲得了ROR1抗體偶聯藥物LCB71在韓國以外地區開發和商業化的獨家授權。根據協議條款,基石藥業將獲得獨家授權,主導LCB71在韓國以外的全球其他地區的開發和商業化。LCB公司則獲得1千萬美元的首付款,及最高可達3.535億美元的里程碑付款和額外的分級特許權使用費。
對比擁有同類型產品VLS-101的VelosBio,默沙東以27.5億美元收購了VelosBio公司全部股份,當時VLS-101處於I/II期臨牀試驗。而擁有2020年10月進入I期臨牀試驗同類型資產NBE-002的NBE Therapeutics,則於2020年12月被勃林格殷格翰以11.8億歐元(約14億美元)收購公司全部股份。
並且從產品本身來看,LCB71的ROR1在包括白血病、非霍奇金淋巴瘤、乳腺癌、肺癌及卵巢癌等多種癌症中都有高表達,在單藥和聯合用藥上對多項實體瘤及血液瘤具有廣泛應用潛力。其採用獨特設計的腫瘤特異切割的連接子和腫瘤激活吡咯並苯二氮卓(PBD)前體毒素,能夠協同解決傳統PBD藥物相關的毒性問題。
圖表十:LCB71獨特結構
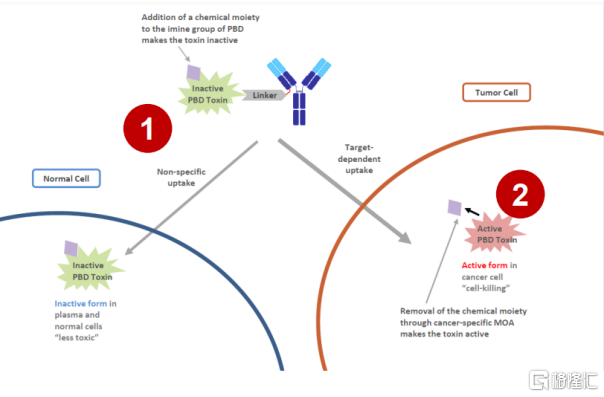
數據來源:公司資料,格隆彙整理
此外,LCB71是目前世界上進度第三的ROR1 ADC,利用定點連接(site-specific conjugation)達到精準的抗體藥物、複合體藥物含量(DAR)控制,利於同質化均一化的大規模生產,未來商業化的生產過程將會更具效率。
由此可見,隨着基石藥業ROR1抗體偶聯藥物LCB71研發的深入,將進一步展現其全球價值。
圖表十一:關於ROR1 ADC的近期交易

數據來源:公司資料,格隆彙整理
小結
基石藥業專注開發潛在同類首創或同類最優的創新藥物,研發管線已經匯聚多個重磅產品。2021年,公司的舒格利單抗(PD-L1抗體)、艾伏尼布(IDH1)、阿伐替尼(KIT/PDGFRA)和普拉替尼(RET)4款產品都有望獲批上市,將覆蓋超過4個適應症。臨牀研發方面,公司將會有5項以上NDA遞交,覆蓋3個產品,30項臨牀試驗,包括15項註冊性研究,多項數據也將發佈。
並且,公司通過與多家國際知名企業和協同效應明顯的合作,讓商業化的模式更加靈活,公司現金流也獲得了優化,這有利於公司在創新研發的道路上行穩致遠。2021年,或許會成為基石藥業最值得市場期待的一年。




