华大基因(300676.SZ):子公司两项新冠检测产品获得CE准入资质
格隆汇 02-10 17:02
格隆汇 2 月 10日丨华大基因(300676.SZ)公布,公司控股子公司深圳华大因源医药科技有限公司(以下简称华大因源)研制的两项新型冠状(以下简称新冠)病毒检测产品于近日获得欧盟CE准入资质。具体情况如下:
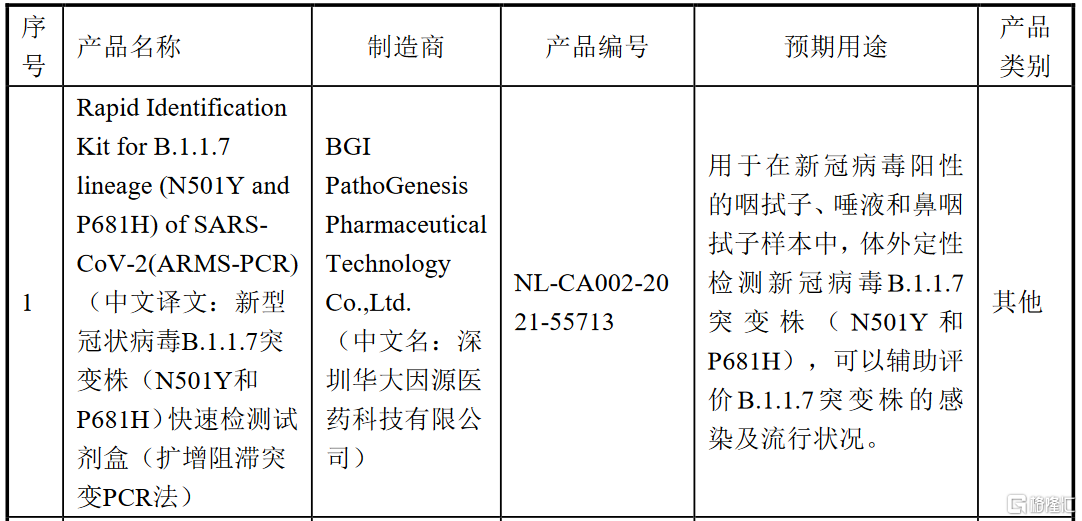
2020年12月,英国向世界卫生组织通报出现新的B.1.1.7新冠病毒株,相关科学研究表明,该变异病毒传播能力比原始毒株更高。快速对B.1.1.7新冠变异病毒作出鉴定已成为目前各国疫情防控工作的重点之一。公司本次获得CE准入资质的第一项产品新冠病毒B.1.1.7突变株快速检测试剂盒(ARMS-PCR法)采用扩增阻滞突变PCR方法,可实现野生型病毒株(501N和681P)和突变型病毒株(501Y和681H)的鉴别诊断,从而有利于新冠病毒变异株的监测。
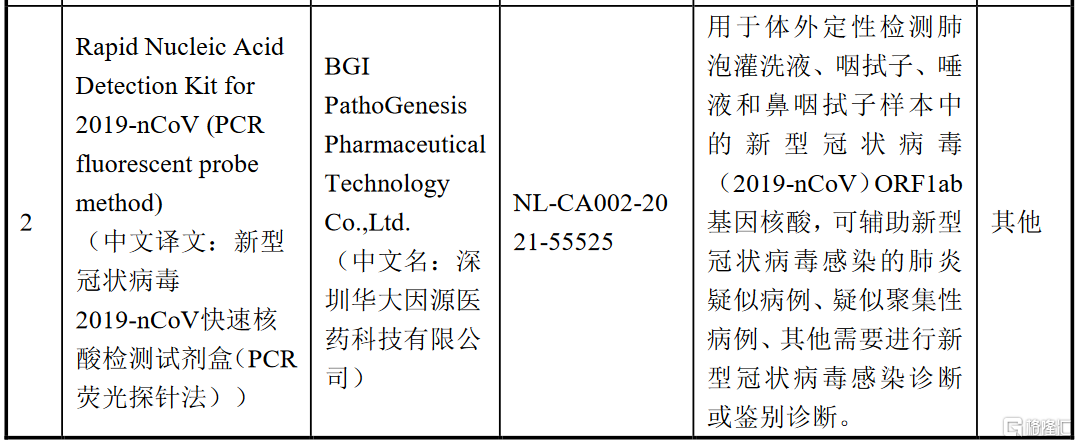
公司此次获得CE准入资质的第二项产品新冠病毒快速核酸检测试剂盒(PCR荧光探针法)采用体外PCR扩增和荧光探针相结合的方法,针对新冠病毒2019-nCoV的高度保守区域以及内参基因设计荧光检测的特异性引物探针。该试剂盒通过采用快速生化反应模式,缩短了检测时间,从而有利于提高新冠病毒检测的效率。
根据欧盟《体外诊断医疗器械指令》规定,华大因源研制的新冠病毒B.1.1.7突变株(N501Y和P681H)快速检测试剂盒(扩增阻滞突变PCR法)和新冠病毒快速核酸检测试剂盒(PCR荧光探针法)产品已经完成了CE申报,并得到了主管机构的确认,这两项检测产品已具备欧盟市场的准入条件。
上述检测产品获得CE准入资质,有利于进一步丰富公司新冠病毒检测产品矩阵,增强公司新冠病毒检测产品的综合竞争力,满足多种应用场景的临床需求,全面助力新冠疫情防控工作。上述产品实际销售情况取决于新冠疫情防控涉及的检测需求,公司目前尚无法预测其对公司未来业绩的影响。
關注uSMART
在 Facebook, Twitter ,Instagram 和 YouTube 追蹤我們,查閱更多實時財經市場資訊。想和全球志同道合的人交流和發現投資的樂趣?加入 uSMART投資群 並分享您的獨特觀點!立刻掃碼下載uSMART APP!

重要提示及免責聲明
盈立證券有限公司(「盈立」)在撰冩這篇文章時是基於盈立的內部研究和公開第三方資訊來源。儘管盈立在準備這篇文章時已經盡力確保內容為準確,但盈立不保證文章資訊的準確性、及時性或完整性,並對本文中的任何觀點不承擔責任。觀點、預測和估計反映了盈立在文章發佈日期的評估,並可能發生變化。盈立無義務通知您或任何人有關任何此類變化。您必須對本文中涉及的任何事項做出獨立分析及判斷。盈立及盈立的董事、高級人員、僱員或代理人將不對任何人因依賴本文中的任何陳述或文章內容中的任何遺漏而遭受的任何損失或損害承擔責任。文章內容只供參考,並不構成任何證券、金融產品或工具的要約、招攬、建議、意見或保證。
投資涉及風險,證券的價值和收益可能會上升或下降。往績數字並非預測未來表現的指標。



