2020年11月16日,康方生物-B(9926.HK)獲得由格隆匯頒發的2020年最具創新力IPO獎。在今年4月成功登陸港交所之後的康方生物,在不到1個月時間在研產品派安普利單抗遞交新藥上市申請,8月成功納入恆生綜合指數、恆生醫療保健指數以及恆生香港上市生物科技指數等成分股。上市至今,Cadonilimab雙抗等核心產品臨牀進度高效推進,商業化進程迅速鋪開。
康方生物上市已有半年之餘,藉此次獲得最具創新力IPO,我們來梳理一下,這家生物醫藥公司的創新力在哪裏?
圖表一:公司獲2020年度最具創新力IPO獎
圖片來源:格隆匯
雙抗賽道領頭羊,研發迅速推進
根據公開披露數據,依託科學家團隊強大的研發實力,康方生物建立了超過20個用於治療腫瘤、自身免疫、炎症、代謝疾病等重大疾病的創新藥物產品管線,包括兩個國際首創的雙特異性抗體新藥(PD-1/CTLA-4以及PD-1/VEGF)。其中10個品種開啟了超過40項臨牀研究項目。管線涵蓋了PD-1、CTLA-4、VEGF、CD47、CD73、IL-12/IL-23、IL-17、IL-4R等創新靶點。
Cadonilimab(PD-1/CTLA-4,AK104):有望成為全球首個獲批的基於PD-1的雙抗藥物
PD-(L)1和CTLA-4都是目前全球熱度最高的免疫治療靶點,據公開數據,PD-1和CTLA-4聯合治療對某些難以治療的癌症類型產生了顯著改善的總體緩解率(ORR),包括腎細胞癌、胃癌、小細胞癌肺癌等。但是這種聯合療法存在較為明顯的毒副作用,由此也限制了聯合療法更加廣泛的應用。正因聯合用藥的療效和毒副作用,科學家希望通過雙抗的設計,在保留或者提升聯合用藥療效的同時,顯著提升藥物的安全性。目前全球範圍內基於PD-(L)1的雙抗已有眾多跨國公司巨頭正在佈局,但尚無產品獲批上市。
康方生物的Cadonilimab(PD-1/CTLA-4,AK104)是目前研發進展最快的產品,2020年3月Cadonilimab單藥治療宮頸癌及5月Cadonilimab單藥治療鼻咽癌分別在美國和中國啟動關鍵註冊性II期臨牀。
2020年10月,康方生物全球首創的新型腫瘤免疫治療雙特異性抗體新藥Cadonilimab(PD-1/CTLA-4,AK104)用於治療復發或轉移性宮頸鱗癌,獲得國家藥品監督管理局(「NMPA」)藥品審評中心(CDE)審核同意,納入“突破性治療品種公示”名單。而在此前2020年6月,Cadonilimab就已經被美國FDA授予了快速審批通道資格。
如果進展順利,Cadonilimab將有望成為全球獲批上市的首個基於PD-1的雙特異性抗體藥物。
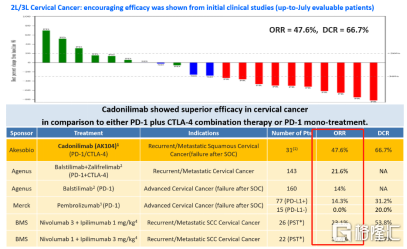
而Cadonilimab之所以能夠在同時快速地獲得美國和中國藥品監管部門高度認可,則是基於Cadonilimab優異的臨牀數據。根據康方生物發佈的Cadonilimab用於二線/三線治療宮頸癌臨牀最新數據顯示,AK104治療晚期宮頸癌的ORR(客觀緩釋率)高達為47.5%,遠高於現有PD-1/CTLA-4單藥或聯合用藥數據,在療效上有顯著的提升。安全性與聯合用藥相比也有明顯提升,與已經公佈數據的PD-1相當。
美國調研機構預測CTLA-4與PD-1聯合用藥的潛在市場規模權威機構預測年銷售規模峯值有望達到133億美元。Cadonilimab的最新數據則預示着該藥未來的市場空間將很有希望超越聯合用藥。
圖表二:AK104用於治療晚期宮頸癌臨牀II期數據
數據來源:公開資料,格隆彙整理
目前,Cadonilimab正在澳大利亞、新西蘭、美國開展二線/三線治療復發或轉移性宮頸癌的單臂註冊性臨牀試驗。主要適應症還包括肝癌、胃癌、肺癌、食管鱗癌及鼻咽癌等。
AK112(PD-1/VEGF雙抗):對PD-1不敏感型實體瘤患者效果良好
AK112是康方生物自主研發另一款全球首個進入臨牀研究的PD-1/VEGF雙特異性抗體。
從藥物設計上來看,AK112是基於康方生物獨特的TETRABODY技術設計,可阻斷PD-1與PD-L1和PD-L2的結合,並同時阻斷VEGF與VEGF受體的結合。鑑於VEGF和PD-1在腫瘤微環境中的共表達,與聯合療法相比,AK112作為單一藥物同時阻斷這兩個靶點,可能會更有效地阻斷這兩個通路從而增強抗腫瘤活性。
目前AK112已經在澳洲和中國開展Ia期臨牀研究。AK112的Ia期研究階段性數據10月已在2020中國腫瘤免疫治療會議上發佈。
研究的結果顯示,在有至少經歷過一次腫瘤評估並對PD-1抑制劑不敏感或接受過PD-1抑制劑治療的11例晚期實體瘤患者中,共有4例達到了緩解(客觀緩解率(ORR):36%),共7例腫瘤縮小且疾病穩定(疾病控制率(DCR):64%)。
特別值得注意的是,上述數據表明PD-1/VEGF雙抗(AK112)有潛力成為突破性的療法,為PD-1抑制劑不敏感或接受過PD-1抑制劑治療的病人帶來新的希望。
另外,與聯合治療相比,AK112能更特異性的在腫瘤組織局部富集,靶向阻斷腫瘤局部的VEGF,解除免疫抑制的微環境,創造一個有利於PD-1發揮作用的微環境,協同抑制PD-1的功能,解除腫瘤細胞對T細胞免疫反應的抑制,發揮最大的抗腫瘤作用,這一理論假設在本臨牀研究中得到了初步驗證。在聯合免疫治療時代,AK112治療前景非常值得期待
圖表三:AK112產品研發進程

數據來源:公司資料,格隆彙整理
AK117(CD47抗體):第二代CD47產品T-cell佔位效果最優,無貧血症狀
CD47靶點是近期比較熱門靶點,今年一季度吉利德以約49億美元的天價收購擁有Hu5F9-G4(CD47單抗,第一代CD47代表產品)的Forty Seven公司,掀起業界對CD47追捧的熱潮。
康方生物在近日召開的SITC會議上首次披露了其自主研發的第二代CD47單抗(AK117)的人體臨牀研究進展。
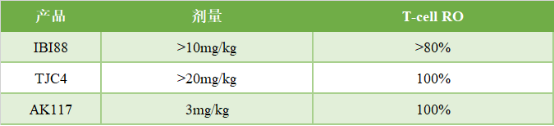
研究顯示,所有正在進行的劑量爬坡隊列中未發生藥物相關的貧血症狀,因此與第一代產品相比,無需使用低劑量誘導。且各隊列受試者對藥物耐受性良好,無劑量限制性毒性(DLT)事件發生。更重要的是,在藥物活性指標方面,受試者外周血T細胞的CD47的受體佔有率(RO)在3mg/kg隊列就已經達到並維持在100%。
初步數據預示着,作為第二代CD47產品,康方生物AK117通過研發設計可能有潛力能夠解決CD47最常見的嚴重血液不良反應問題,從而獲得更好的安全性。低劑量即體現了極高的藥物活性,預示着其療效方面也具備潛力優勢。AK117很有潛力成為CD47賽道下一顆閃亮的星。
目前,AK117的20mg/kg QW劑量組正在籌備中。
圖表四:國內上市CD47抗體爬坡數據對比
數據來源:公開資料,格隆彙整理
AK119(CD73抗體):新西蘭用於治療COVID-19的臨牀試驗完成首例健康受試者給藥
AK119是人源化單克隆抗體藥物,可有效地引起B細胞活化並加強抗體產生,抑制CD73的酶學活性。
根據臨牀前數據顯示,AK119可通過不同於抑制CD73酶活性的途徑,上調B細胞活化的兩個早期標記分子(CD69和CD83)的表達,還可促進B細胞產生免疫球蛋白M(IgM)和免疫球蛋白G(IgG)抗體。COVID-19患者增加抗體產生或可會加強彼等消除SARS-CoV-2病毒的能力。因此,AK119或會是治療COVID-19疾病的有效方法。此外,AK119亦可能使人體對SARS-CoV-2病毒產生更強的免疫力,並可能與健康人士接種的疫苗結合使用,以增強疫苗的效力。
目前,AK119在美國用於治療輕中度COVID-19患者的臨牀試驗已經獲得美國FDA的反饋,同意公司遞交新藥臨牀試驗申請。今年10月,AK119在新西蘭的臨牀試驗完成COVID-19首例健康受試者給藥。
另外,AK119還將與Cadonilimab聯用,探索治療實體瘤、胰腺導管腺癌、結直腸癌等重大疾病。
派安普利(PD-1單抗):潛在Best-in-Class單克隆抗體,中國新藥上市申請階段
派安普利單抗是由康方生物與中國生物製藥旗下正大天晴共同開發和商業化的重組人源化抗PD-1單克隆抗體。相較於市面上已經銷售的PD-1抗體,派安普利具有結構設計獨特,臨牀試驗數據優秀。
從研發進展上來看,今年5月,派安普利在用於治療復發/難治療性經典霍奇金淋巴瘤(r/r cHL)已經向國家藥監局遞交新藥上市申請,預計2021年獲批上市。今年10月,派安普利用於治療三線鼻咽癌到達了主要臨牀重點,並獲得美國食品藥品監督管理局(FDA)授予的快速審批通道資格(FTD)。
臨牀研究數據方面,派安普利單抗至少進行了2次療效評估的r/r cHL受試者中表現出了顯著的臨牀獲益。其中,客觀緩解率(ORR)達到83.6%。完全緩解率(CR)達到49.3%,明顯高於歷史對照,也優於有條件上市的PD-1單抗;在治療轉移性鼻咽癌方面,經確認的ORR為27.0%,疾病控制率(DCR)為49.5%。安全性方面也優於市售PD-1單抗產品或相當。
此外,派安普利更多大適應症的拓展也已經進入到中後期階段。其中派安普利和化療聯用治療一線鱗狀非小細胞肺癌完成了臨牀III期入組,一線非鱗非小細胞肺癌聯用化療和聯用安羅替尼處於臨牀III期,非小細胞肺癌的新輔助/輔助療法+化療/+安羅替尼也處於臨牀II期,和化療、安羅替尼聯用治療肝癌、胃癌等大適應症的臨牀在同時進行。
優異的臨牀療效+大適應症後期臨牀快速推進+中國生物製藥強大的專業銷售能力,派安普利有望成為國內PD-1領域的主角。
圖表五:AK105產品研發進程

數據來源:公開資料,格隆彙整理
小結
整體來看,相較於剛上市時候的康方生物,如今的康方在產品管線上做了多項更新。無論是新藥上市申請的遞交,還是臨牀研發進度,一切都在向商業化進程上不斷推進。
之所以可以稱得上具有創新力,一方面的原因來自於其在雙抗賽道深遠佈局和高效推進,另一方面原因來自於其研發項目均為自主研發項目,所有主推產品全部順利進入臨牀只中後期,且與同靶點藥物相比體現出更好的療效或安全性。
腫瘤免疫療法因療效好、副作用小、複發率低的優點,被稱為腫瘤治療的第三次革命。基於PD-1的雙抗產品,則是被學術界共同認可的腫瘤免疫療法未來最具潛力的領域。於康方而言,最快的雙抗產品Cadonilimab已經進入新藥上市申請階段,倘若成功獲批,Cadonilimab將成為全球首個以PD-1作為基礎的雙抗藥物,企業價值空間將會被進一步打開。更多如CD47、CD73等潛力巨大靶點的迅速推進和優勢數據結果,更加突出了康方生物在抗體藥物領域的創新實力和商業化潛力。
對於研發能力,尤其是一家創新藥企,通常而言有兩條路可以選,一種是自我研發,利用公司內部的研發實力,從而獲得具有競爭力的創新藥,另一種則是通過外部引進的方式,來完善公司的研發管線。康方生物是一家實打實通過自我研發走出國門的藥企,成為了中國第一家向全球製藥巨頭默沙東授權自主研發抗體許可的中國生物科技公司。而這樣的研發實力,或許在未來還將帶來不一樣的驚喜。
從上市以來的公司股價表現來看,公司股價在上市受到投資者的關注與追捧,截止發稿日,上市以來最高股價達到38.95港元/股,區間漲幅最高達到140.74%。
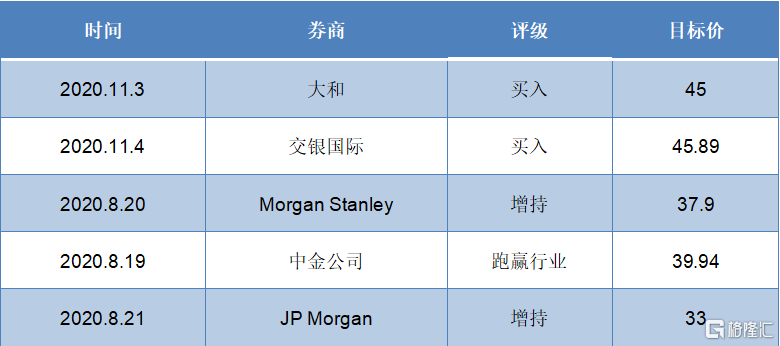
基於康方生物在生物製藥領域的強大研發實力和高效進度,各大券商對於公司未來的發展仍然非常看好。其中,摩根大通與摩根士丹利均給予“增持”評級,中金公司給予“跑贏行業”評級,交銀國際以及大和給予“買入”評級,最高目標價達到45港元/股,高於此前公司最高股價,值得持續關注與期待。
圖表六:券商評級
數據來源:WIND,格隆彙整理




