作者 | 天南
數據支持 | 勾股大數據
來源 | 格隆匯研究(ID:glh_tushuocaijing)

這段時間港股市場迎來了不少知名的生物科技企業,在最新的名單中,藥明系的藥明巨諾-B(2126.HK)已經進入招股期,2020年11月3日上市,發行價20~23.25港元,每手500股,入場費12019港元。藥明系已經有三子上市,這第四子質地究竟如何呢?
01
藥明巨諾是2016年Juno和藥明康德(通過圈子附屬公司上海藥明)成立的,主要是做臨牀及臨牀前階段細胞治療公司,公司已經建立了一個專注為血液癌症及實體瘤開發、製造和商業化突破性細胞免疫療法的一體化平台。
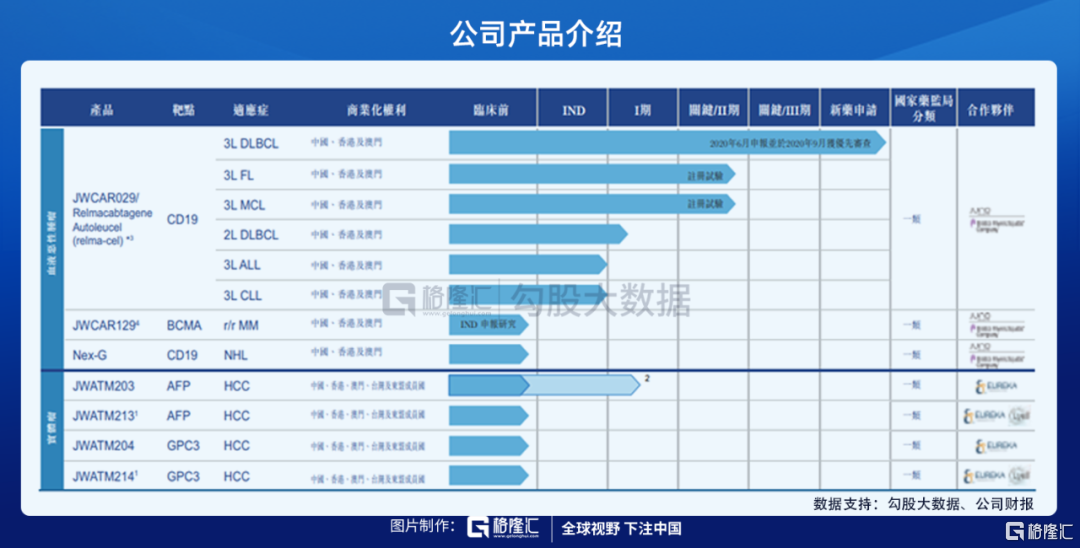
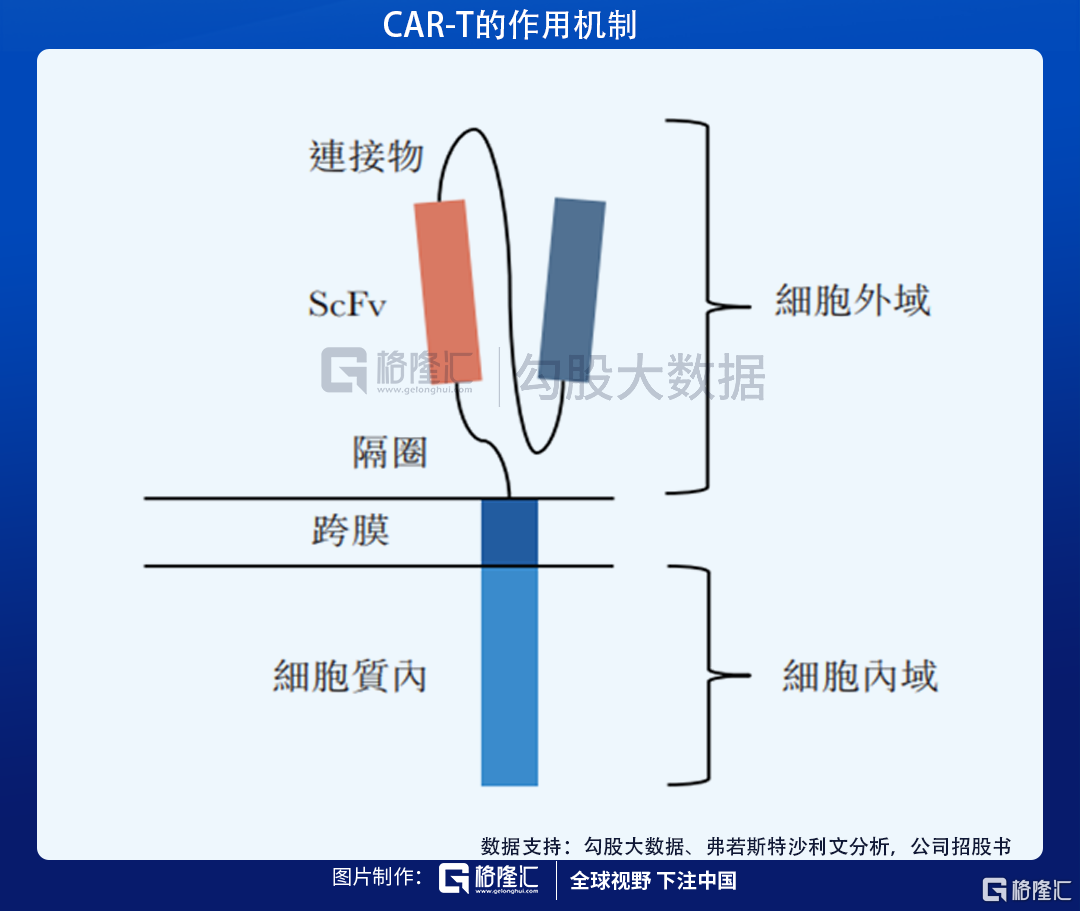
公司主打的候選產品,也是目前進展最快的是Relmacabtagene autoleucel(Relma-cel)是針對復發或難治(r/r)B細胞淋巴瘤的抗CD19CAR-T療法,國家藥監局已經在2020年6月受理審查將relma-cel用作DLBCL三線療法的新藥申請,Relma-cel有望成為國內首個獲批的一類生物製品CAR-T療法,並有望成為同類中的最佳療法。
考慮到中國前線治療的有效性,2019年relma-cel的目標適應症(即3L DLBCL、3L FL及3LMCL)於中國的目標市場估計約分別為28,700、5,200及3,400名患者。但是因為對於可以使用CAR-T療法並未普及,需求也沒有得到滿足,中國CAR-T治療市場規模預期由2021年的6億元人民幣增至2024年的54億元人民幣,再進一步增至2030年的243億元人民幣。但是CAR-T作為新興療法,風險性較高。
血液瘤中第二個產品,JWCAR129是公司治療多發性骨髓瘤(MM)而正在開發的一種自體CAR-T療法。MM是一種強進展性疾病,約佔所有血液惡性腫瘤的10%。由於患者復發後現有療法難以治癒,所以仍然存在治療MM的大量醫藥需求。公司的一類創新藥JCAR129以B細胞成熟抗原(BCMA)為靶點,BCMA是一種在眾多血液惡性腫瘤(包括MM)高度表達的蛋白質。公司正就該候選產品進行IND所需的臨牀前藥理學、毒理學研究和製造流程開發研究,計劃最早於2021年上半年開始臨牀研究。
除了在血液瘤領域,公司在實體瘤上也有所佈局,公司主要與優瑞科及Lyell Immunopharma, Inc.(Lyell)的合作,公司正在開發T細胞候選療法,目前在增強T細胞的療法、持久性以及向實體瘤的滲透,提升安全性。治療實體瘤的細胞療法目前在研的核心品種JWATM203是以甲胎蛋白(AFP)為靶點治療的肝細胞癌(HCC)的自體T細胞受體模擬T細胞療法,是潛在的甲胎蛋白陽性HCC患者的絕佳治療手段。HCC治療領域依然有很大的醫療需求未被滿足,優瑞科已經在美國推動其AFP TCRm T細胞療法候選產品進行I/II期臨牀試驗。通過與Lyell合作,公司正在開發另一種以AFP為靶點治療HCC的自體TCRm T細胞療法JWATM213,進一步加強T細胞功能並提高療效。
是實體瘤領域,公司還有JWATM204是以磷脂酰肌醇蛋白聚糖-3(GPC3)為靶點的新型自體T細胞療法候選產品,JWATM204有潛力成為GPC3陽性HCC患者的絕佳治療手段。與JWATM203及JWATM213相似,公司將利用Lyell的技術開發另一種以GPC3為靶點的自體T細胞療法候選產品JWATM214。
公司沒有進行內部產品的開發,均是與合作方Juno、優瑞科及Acepodia等一起合作開發,但是從中長期的發展來説,公司需要具備自身的開發能力,公司預計於2020年6月獲優瑞科授權引進Artemis平台。優瑞科的Artemis平台是JWATM203及JWATM204的基礎。Artemis平台是一個新型技術平台,主要是針對T細胞療法進行研發。公司在2020年6月與優瑞科訂立的協議,獲得JWATM203及JWATM204在中國、香港、澳門、台灣及東盟成員國開發、製造及商業化的授權以及使用Artemis平台的權力以改良該等產品,也獲得獨家授權可以在司法權區使用Artemis平台將優瑞科開發的所有產品商業化。
除此之外,公司與Juno和Acepodia建立合作關係,在中國、香港和澳門,對於Juno管線中五種T細胞工程產品的優先購買權,包括CD22、、WT1、CD171、MUC16及ROR1;Acepodia管線HER2的同種異體自然殺傷(NK)細胞治療產品的權利的選擇權。
產能方面,公司在蘇州新建了約9,976平方米用於商業化製造,共放置四個獨立模塊,目前2個模塊已經建成,按照國際cGMP及QMS標準營運。這些設施可以支持多種類細胞平台,包括使用基因改造的自體T細胞及NK細胞、使用基因改造或非基因改造的腫瘤浸潤淋巴細胞(TIL)、基因改造的同種異體免疫細胞的平台,以及生產臨牀級別的用於細胞產品基因改造的病毒載體的設施。目前產能最多可以支持最多5000名患者的治療。
02
公司目前有望快速進入商業化的是Relmacabtagene autoleucel(Relma-cel)是針對復發或難治(r/r)B細胞淋巴瘤的抗CD19CAR-T療法,從競爭格局來看,全球在2017年獲批上市了兩款CAR-T產品Yescarta和Kymriah,2017年的市場規模為1300萬美元,增長到2019年的約7.34億美元,預期到2024年將增長到47億美元,到2030年將增長至181億美元,2019~2024年的複合增長率為45.3%,2024~2030年的年複合增長率為25%。
國內目前還沒有獲批的CAR-T產品,隨着新產品的獲批上市,預計2021年國內市場可以達到6億人民幣,2024~2030年的複合年增長率達到28.7%,從54億人民幣規模增長到243億人民幣。

國內進展較快的除了藥明巨諾,還有復星醫藥的復星凱特,也是與海外公司Kite Pharma(被吉利德收購)合營的復星凱特,目前產品益基利侖賽注射液(擬定)已經獲得藥監局上市註冊審評受理,因為YesCarta是已經在海外上市的成熟產品,有大量的海外臨牀數據,在國內做橋接臨牀試驗即可,審批速度較快。復星凱特此次報的適應症為成人復發難治性大B細胞淋巴瘤治療(包括瀰漫性大B細胞淋巴瘤DLBCL非特指型、原發性縱隔B細胞淋巴瘤PMBCL、高級別B細胞淋巴瘤和濾泡淋巴瘤轉換的DLBCL)。
另外,金斯瑞的子公司南京傳奇與楊森國際聯合開發B細胞成熟抗原(BCMA)CAR-T療法也在美國和中國都開展臨牀,2019年4月拿到了歐洲藥監局的優先審評,在去年12月的ASH會議上,所公佈的臨牀數據,劑量僅需要Bluebird(同賽道一家美國公司)的1/10,Ib/II期臨牀中位觀察6個月的客觀緩解率達到100%,III期研究已經啟動,預計2021提交美國上市申報,因為已經進入FDA“突破新療法”,一般申請上市後3~6個月即可獲批。
公司是否具備盈利能力,很大程度上依賴CAR-T產品是否能成功,單藥的風險性較大,目前按發行價20~23.8港元來計算,市值在75.24萬~89.53萬港元,金斯瑞的傳奇生物(LEGN)在美股上市目前的市值為36億美元(約279億港元),但是傳奇如上所説,具有中美兩地臨牀,美國有望在2021年提交上市申請,所以藥明巨諾行向對比需要有折價空間。對於沒有盈利的生物科技公司,100億~150億市值是一個坎,具體還是要看上市後銷售渠道的佈局、定價、醫保等綜合因素進行判斷。
格隆匯聲明:特別提醒,投資決策需建立在獨立思考之上,本文內容僅供參考,不作為實際操作建議,交易風險自擔。




