近日,復宏漢霖-B(2696.HK)旗下的曲妥珠單抗漢曲優®(HLX02,歐盟商品名:Zercepac®)正式獲得國家藥品監督管理局(NMPA)批准上市,成為首箇中歐兩地獲批上市的國產單抗生物類似藥。漢曲優®的獲批實現了國產曲妥珠零的突破,打破曲妥珠單抗自2002年國內上市以來長期只有單一品種在市銷售的局面,有望改變國內抗HER2治療格局。同時,作為首個登陸歐洲市場的“中國籍”單抗生物類似藥,漢曲優®更開闢了中國醫藥企業參與單抗生物類似藥“世界盃”比賽的先河。
國產替代與國際競爭並重
在中國臨牀腫瘤學會發布的《乳腺癌診療指南》中,曲妥珠單抗聯合化療被推薦為HER2陽性乳腺癌術前治療方案(I級推薦)、HER2陽性早期乳腺癌術後輔助靶向治療(I級推薦)以及 HER2 陽性晚期(復發轉移)乳腺癌的抗 HER2 一線和二線治療方案(I級推薦)。曲妥珠單抗在乳腺癌全程治療中起到了奠基石的作用。然而長期以來在中國上市的曲妥珠單抗僅有國外藥企羅氏的赫賽汀®,自該藥2002年上市以來已獨家佔據市場長達 18 年。
在這樣的局面下,進口藥物費用昂貴,年度治療費用高達10萬,給患者家庭帶來沉重的用藥負擔;隨着該藥被納入醫保目錄,又一度出現醫保報銷範圍內藥物供應緊張,部分地區無法及時調配藥物的局面。醫生、患者與市場都期待出現新的破局者,能夠提供價格可及的優質藥物,穩定持續滿足日漸增多的乳腺癌患者的用藥需求。
根據官方發佈的臨牀試驗(1期與國際多中心3期)結果,復宏漢霖自主開發與生產的漢曲優®(HLX02)與原研曲妥珠在藥代動力學特徵、安全性、耐受性和免疫原性上皆相似,兩者無臨牀意義上的差異。此次漢曲優®也獲批了赫賽汀®在中國已獲准的全部適應症,使得中國HER2陽性乳腺癌和胃癌患者終於增加了新的曲妥珠單抗的用藥選擇。
不僅於此,2020年4月,HLX02曲妥珠單抗原液(DS)和製劑(DP)線順利通過歐盟GMP現場核查,正式獲得了兩項歐盟GMP證書。歐盟GMP認證是國際公認的最權威和嚴謹的認證之一,歐盟GMP認證被也視為藥品登陸國際市場的“通行證”。一個多月後,歐洲藥品管理局EMA發佈積極審評意見,表示“HLX02與參照藥赫賽汀(曲妥珠單抗)高度相似,研究數據支持HLX02在質量、安全性與療效等方面與赫賽汀均無顯著差異”,建議批准HLX02的上市銷售許可申請。2020年7月27日,歐盟委員會同意HLX02(曲妥珠單抗,歐盟商品名:Zercepac®)在歐盟上市,適應症範圍包括HER2陽性早期乳腺、HER2陽性轉移性乳腺癌以及HER2陽性轉移性胃癌,即赫賽汀®已獲准的全部適應症。漢曲優®由此成為首個登陸歐洲市場的“中國籍”單抗生物類似藥,開闢了中國醫藥企業參與單抗生物類似藥“世界盃”比賽的先河。
需求與供應,現實與未來
曲妥珠單抗(赫賽汀®)於1998年在美國上市,是HER2陽性乳腺癌治療的“金標準”藥物。經過了20年發展,曲妥珠單抗2018年全球銷售額仍超過70億美元,排藥品世界銷售額第七位。而乳腺癌在2018年發病率位居全球惡性腫瘤第二位,同時位居女性惡性腫瘤第一位,在癌症患者基數持續上漲的背景下,曲妥珠單抗的需求持續強勁,廣大患者羣體對高品質生物類似藥需求旺盛。
圖表 1:赫賽汀全球歷年銷售額

資料來源:Bloomberg,興業證券經濟與金融研究院,格隆彙整理
自2002年上市以來,曲妥珠單抗在中國的銷售額穩步上升,銷售額上升的主要限制在於能夠負擔藥物開支的患者羣體有限。自2017年曲妥珠單抗加入我國醫保後藥品使用總量急劇上升,但需求的急劇釋放也導致了藥品供應不足的等問題。
圖表 2:曲妥珠單抗國內銷售額
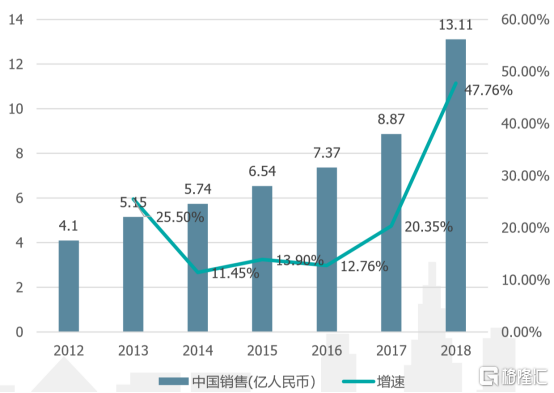
資料來源:興業證券經濟與金融研究院,格隆彙整理
綜上所述,曲妥珠單抗目前在國內處於需求旺盛,但供應不穩定的局面。該局面下復宏漢霖開發的國產生物類似藥憑藉與原研一致的療效和國際質量品質,將有充足的市場空間——漢曲優®有望利用本土生產的優勢保持充足供貨,填補國內用藥需求,同時走出國門,參與分配國內外市場份額,代表中國本土生物藥打世界盃。
據悉,復宏漢霖已為產品的全球化產能需求作好了充分準備。公司已將現有11000平方米的徐匯生物藥生產基地的商業化產能擴至20,000L,並同步啟動松江基地(一)與松江基地(二)的建設。松江基地(一)預計產能達24,000L,現已完成臨牀樣品的試生產,松江基地(二)總佔地面積達到約200畝,一期智能化工廠也正在建設中。
市場關注與贊同
復宏漢霖是中國抗體藥龍頭企業之一,在單抗生物藥的研發和國際化方面進度領先,綜合競爭實力強勁。基於以上客觀條件,多家外部券商給予復宏漢霖積極的評級。招銀國際維持“買入”評級,目標價57.21港元,花旗首次給與“買入”評級,目標價58港元,光大證券首次給與“買入”評級,目標價64港元。隨着外部逐漸發掘企業投資價值,市場關注度也在不斷上升,復宏漢霖(2696.HK)自6月12日開始成交量逐步放大,6月16日單日漲幅超過14%,短期盤整之後7月10日開啟新的一輪放量上漲,四個交易日實現25%的漲幅。放量資金的進入也是市場對企業潛在盈利預期的認可,關注度上升,市值上漲,產品投產後轉化為實際業績支撐市值,促使業績與估值成為一個正向反饋的循環。
小結
隨着本次HLX02漢曲優®的在國內及歐盟地區雙雙獲批,復宏漢霖實現了國產曲妥珠單抗零的突破,並使得“中國籍”單抗生物類似藥首次登陸歐洲市場。該產品優異的質量和嚴格的開發、生產過程使得其與原研藥在質量、有效性與安全性上達到了高度相似,將為復宏漢霖打開國內外這一生物醫藥主流市場的大門。憑藉全球對曲妥珠單抗的旺盛需求,復宏漢霖立足國內、佈局全球,有望充分發揮本土生產優勢佔據市場,並憑藉穩定的生產工藝贏得國際認可打開國際銷售之路。在這商業化現實條件充分,企業國內外盈利前景明朗的市場背景下,復宏漢霖有望走好國內國產替代、國外優勢競爭的“內外”兼修之路。




