基石藥業-B(2616.HK)是一家以腫瘤免疫治療聯合療法為核心的生物製藥公司,專注於開發商業化創新腫瘤免疫治療及精準治療藥物。2020年3月26日,基石藥業-B(2616.HK)發佈了2019年業績公告,扣除以股份為基礎的付款開支後,研發開支為人民幣11.8億元,較2018年增加4.6億元。扣除優先股轉換特徵公平值變動及以股份為基礎的付款開支的影響後,虧損人民幣11.4億元。
一、產品管線:進度快、覆蓋廣
目前,公司建立了一條15種腫瘤候選藥物組成的豐富產品管線,其中6款候選藥物正處於關鍵性臨牀試驗,ivosidenib在2019年獲美國FDA批准上市,並且已向台灣提交了NDA申請,avapritinib在美國和歐盟的NDA申請已被受理。
圖表一:公司產品及研發進度
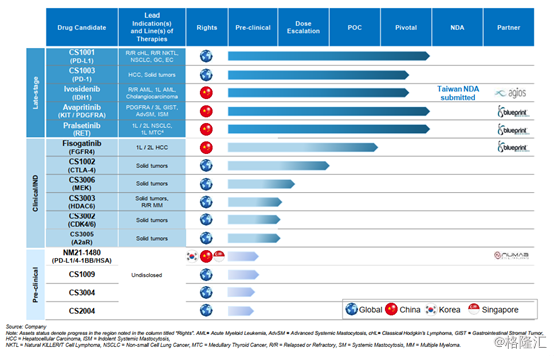
數據來源:公司業績報告資料,格隆彙整理
在靶點佈局上,基石藥業是中國唯一一家同時擁有臨牀階段PD-L1、PD-1和CTLA-4的公司,2019年共計有11項聯合療法試驗,其中5項為註冊試驗。其適應症範圍覆蓋到55%以上的癌症。
圖表二:癌症覆蓋情況
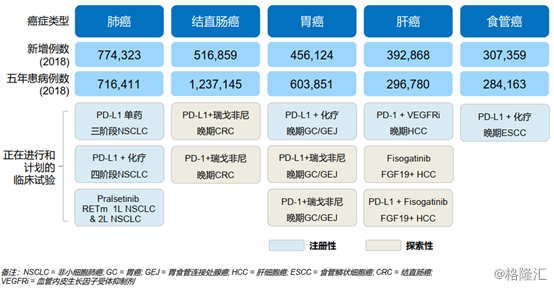
數據來源:公司業績報告資料,格隆彙整理
二、臨牀試驗進展:多項產品多點開花
從臨牀試驗進展上來看,基石藥業在2019年共計有28項臨牀試驗,其中有13項是註冊性研究。
圖表三:註冊性臨牀試驗
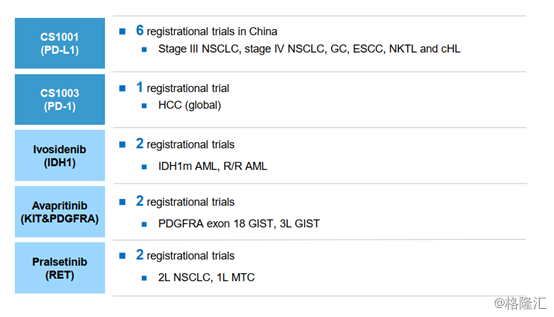
數據來源:公司業績報告資料,格隆彙整理
1、 CS1001(PD-L1):6項臨牀試驗正在進行
核心產品CS1001(PD-L1)針對的是中國首個全人源、全長的IgG4-L1單克隆抗體,在早期臨牀試驗中已獲得安全有效的結果,有望成為中國推出的首個國內自主研發的抗PD-L1藥物。到目前為止,CS1001(PD-L1)共有6項註冊性臨牀試驗正在進行,並且規劃有更多針對大適應症的聯合療法。
圖表四:CS1001(PD-L1)的臨牀試驗進展

數據來源:公司業績報告資料,格隆彙整理
2、 其他產品全球研發和註冊進展
公司正在研發的四項創新精準治療藥物中,ivosidenib(CS3010)在兩項適應症上獲得NDA批准,大中華地區也已經提交審批。pralsetinib(CS3009)已提交兩項適應症的NDA審批,avapritinib(CS3007)也有一項適應症已通過NDA審批,一項適應症提交NDA審批,兩項適應症預計12020年提交NDA審批。另兩項腫瘤免疫骨幹產品CS1002(CTLA-4)和CS1003(PD-1)也在一期試驗中取得不錯的結果。
圖表五:其他創新藥的全球研發和註冊進展

數據來源:公司業績報告資料,格隆彙整理
三、優質商業拓展及明確的商業模式
1、與頂尖生物醫藥公司合作,獲得世界級優秀資產
基石藥業通過與頂尖生物醫藥公司合作,獲得了tibsovo(IDH1)、avapritinib(KIT&PDGFRα)、pralsetinib(RET)、fisogatinib(FGFR4)、ND021等優質資產。此外,三個IO聯合治療臨牀合作項目也達成合作。
圖表六:商務拓展情況

數據來源:公司業績報告資料,格隆彙整理
2、明確的商業模式以匹配多個適應症產品的上市
基石藥業的商業模式分為三個階段,第一階段是為大中華區建立帶有核心功能的商業化組織,重點是自建商業化模式同時探索潛在的價值驅動的戰略合作關係。第二階段是針對多種主要適應症的PD-L1和引進資產的全面上市,實現擴充大中華區商業化佈局的目的。第三階段是讓第一波產品在海外上市,和合作夥伴一起擴充全球商業化組織。
圖表七:商業化進程
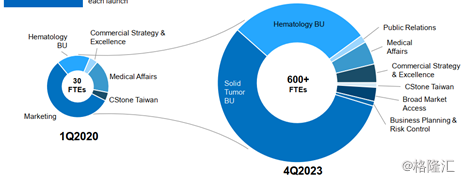
數據來源:公司業績報告資料,格隆彙整理
四、2020年發展規劃
根據公司數據披露顯示,中國PD-(L)1市場預測達到50-100億美金,CS1001針對現有適應症峯值銷售額預計達到7億美金,此外,基石擁有全球同類首創IDH1抑制劑TIBSOVO®、PDGFRA/KIT抑制劑avapritinib和潛在同類首創RET抑制劑pralsetinib、FGFR4抑制劑fisogatinib可應對廣泛的癌症類型。預計在2020年底,基石臨牀試驗將達到三十項以上,註冊項目達到十五項。
圖表八:基石2020年規劃
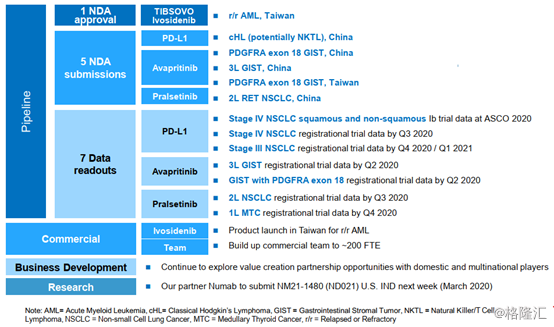
數據來源:公司業績報告資料,格隆彙整理
與此同時,公司為生物製劑及小分子配備強大的生產能力,目前已與新建元(蘇州工業園區所屬企業)簽訂協議建設生產基地,規劃總計容面積近100,000㎡,預計產能達到26,000L大分子生物藥和10億片小分子化學藥片劑和膠囊。伴隨商業化的深入及商業模式的進一步搭建,產品、工廠、商業化三駕馬車齊頭並進,2020年基石藥業的未來發展值得期待。
五、Q&A
Q1:PD-L1如何能夠在市場中勝出?
A1:由於我們的PD-L1獨特的產品設計,是全人源、全長的IgG4單克隆抗體 ,使得我們在臨牀上有獨特的療效和安全性的優勢。特別是在食管癌和復發難治的NKTL展現出色的療效,在一項晚期食管癌的臨牀試驗中,我們的PD-L1達到了77.8%的總緩解率並且到目前為止中位緩解時間DOR仍未達到。根據去年我們在ASH公佈的數據來看,我們的PD-L1在NKTL適應症上顯示了超過33.3%的CR(完全緩解)率,我們也預計將在2020年繼續發佈相關的數據。除了獨特的臨牀療效以外,我們在超過中國癌症發病的55%的高發病的癌症都有後期的臨牀試驗正在進行,並在5年內上市包括III期&IV期的肺癌,食管癌,胃癌,肝癌和腸癌的一線適應症在中國上市。這樣的佈局使得我們的PD-L1在未來的市場準入和規模經濟帶來競爭優勢,同時,在生產方面我們與藥明的合作生產和正在自建的生產基地,帶來雙重的生產能力為未來PD-L1的大規模供應提供有力保障。
Q2:大中華地區的商業化情況。
A2:隨着2021年將會有4個產品5個適應症在大中華地區上市,我們經過詳盡的市場調查,制定了我們的商業化策略包括產品定位,市場準入和人才策略。在市場營銷策略和模型預測方面,我們也確立了自己的商業模式,將打造一支腫瘤領域的專業隊伍,到今年年底我們將成立近200人的商業團隊,在2021年擴招到超過400人的團隊,並且在2023年打造一支超過600人覆蓋到海外市場的商業團隊。目前我們招聘全方位商業化人才的工作已經開始,已經有一批優秀的行業精英加入,建立一個強大的商業團隊以打造基石藥業成為中國創新生物製藥的領先公司。
Q3:公司目前的現金狀況如何?
A3:公司的現金狀況良好,目前現金餘額健康,從目前的現金消耗來看,能夠支持我們到2021年下半年。
Q4:中國本地腫瘤免疫以及精準治療的商業進程,是否擔心其他公司產品競爭?
A4:接下來我們有幾個項目在中國大陸和中國台灣將會有重大的進展。其中包括ivosidenib在台灣的NDA批准,以及PD-L1、avapritinib,pralsetinib的多個適應症的5項NDA申請等。基於中國的人口基數,這些精準治療的產品將是一個非常可觀的市場,由於我們的產品都是具有突破性治療效果的產品,加上其強大的專利保護和顯著的療效將會使我們擁有核心市場競爭力。我們的商業化團隊將總結行業經驗,制定精準治療的市場準入策略,並且和腫瘤領域的專家和診斷公司合作,能夠找到對這些精準治療藥物獲益的人羣,及早滿足中國和全球癌症患者的殷切醫療需求。




