作者:神龍大俠
來源:醫藥魔方
歲末之際,新冠肺炎疫情突如其來,風暴席捲全球,舉世震驚,更不必説風暴中心的中國。
國內外的科研領域大舉出動,迅速鎖定元兇2019-nCov,把基因圖譜、蛋白序列、受體途徑等各方面第一時間被剖析得清清楚楚。在一線臨牀醫生與死神搶救病人的同時,後方科研人員也在爭分奪秒,針對2019-nCov的特性,試圖找出最有效的對抗武器,抗感染藥物研發的關注度也被迅速提升。如果Achaogen、Melinta 這些新型抗生素研發企業能熬到今年,沒準有機會逃過破產的厄運。
剋制2019-Conv:來自HIV的借鑑?
和SARS病毒一樣,2019-Conv屬於冠狀病毒,是具囊膜(envelope)的線性正鏈單股RNA病毒。多種RNA病毒都是入侵人類社會的慣犯,包括聞之色變的埃博拉、流感、甲肝、丙肝等等。其中影響力最大、積累鬥爭經驗最豐富的,莫過於人類纏鬥了幾十年的HIV。有鑑於此,當確認了2019-nCovRNA病毒身份後,許多科學家的第一反應是:我們能否從對抗HIV的經驗中,找出幾件稱手的武器,面對2019-nCov能夠與之一戰?
所以我們看到,在一線的嘗試中,包括中國衞健委發佈的《新型冠狀病毒感染的肺炎診療方案(試行第五版)》,推薦使用HIV治療藥物克力芝(洛匹那韋/利托那韋LPV/r)用於新型冠狀病毒治療。另外,李蘭娟團隊也推薦了用於治療HIV-1感染的蛋白酶抑制劑達蘆那韋。

希望這些已被證明行之有效的HIV治療藥物,能夠在與2019-nCoV的戰鬥中同樣產生積極的效果。而科學家與HIV的戰鬥仍在持續,面對狡猾且善於隱藏的病毒,他們希望找到更加高效和徹底的抗病毒治療策略。
今年1月Nature發表的一篇研究也為HIV治療提供了新的思路。迄今為止,HIV感染體內感染無法被徹底清除,很大的問題在於,經過長期抑制治療後,HIV病毒會在細胞中以潛伏(latency)的方式進行隱藏,躲避免疫系統攻擊。科學家嘗試通過“激活並殺死”(shock and kill)的方法,將病毒從潛伏的受感染細胞中驅趕出來,再進行清除,不過一直以來成效不大。

在這項研究中,來自北卡羅來納大學夏洛特分校的Victor Garcia實驗室成功激活了血液以及受到抗病毒治療抑制的骨髓-肝-脾臟(BLT)組織中的NF-κB信號通路,從而逆轉了HIV的潛伏狀態,誘導其基因重新激活和表達[1]。在該過程中,研究人員使用了一種藥物AZD5582,作為關鍵的“潛伏逆轉劑”(latency-reversal agents, LRAs)。
IAP家族:NF-κB通路&靶向凋亡
AZD5582是靶向細胞凋亡信號通路的藥物,其靶點是細胞凋亡抑制蛋白家族(inhibitor of apoptosis proteins , IAPs)。細胞凋亡是抗腫瘤藥物重要的研發方向之一。IAP家族在哺乳動物中一共有8個成員:NAIP,cIAP1,cIAP2,XIAP,Survivin,Apolon(BRUCE),ML-IAP(Livin; K-IAP)和ILP2(TsIAP)。這個家族的共同特徵是至少包含一個含70-80個氨基酸的桿狀病毒IAP重複序列(Baculoviral IAP Repeat),稱為BIR結構。
AZD5582也正是結合到該區域BIR3區域。另外XIAP,c-IAP1,c-IAP2,ML-IAP在C端有1個指環結構。它是一類多功能蛋白,不僅通過BIR結構域直接結合並抑制caspase的活性,從而抑制凋亡;還能促進有絲分裂激酶信號傳導和細胞增殖和侵襲。
cIAP1,cIAP2和XIAP是IAP家族的主要成員,cIAP1和cIAP2的結構(僅差14個氨基酸)和功能非常相似。XIAP可以結合諸如caspase-3、caspase-7、caspase-9等關鍵的促凋亡節點。其他成員諸如cIAP1、cIAP2則是通過調控NF-κB信號通路中的某些關鍵蛋白的泛素化狀態,實現對整個凋亡通路的調控。最新的HIV研究正是利用了IAP家族成員的這一特性。
IAP蛋白高度表達且與多種癌症相聯,包括肺癌、頭頸癌、乳腺癌、胃腸癌,以及黑色素瘤和多發性骨髓瘤等,並且和預後密切相關。因此,IAPs是抗腫瘤藥物研發的重要方向。
迄今,已進入臨牀研究階段的IAP小分子抑制劑有:AT-406(Debio1143)、GDC-0152、LCL161、TL32711(Birinapant)、BI 891065以及APG-1387。該靶點在全球尚未有藥物獲批適應症,進展最快的抑制劑處於臨牀Ⅲ期階段。AZD5582和其他幾個在研的IAP抑制劑的結構式和對靶點親和力比較如下:
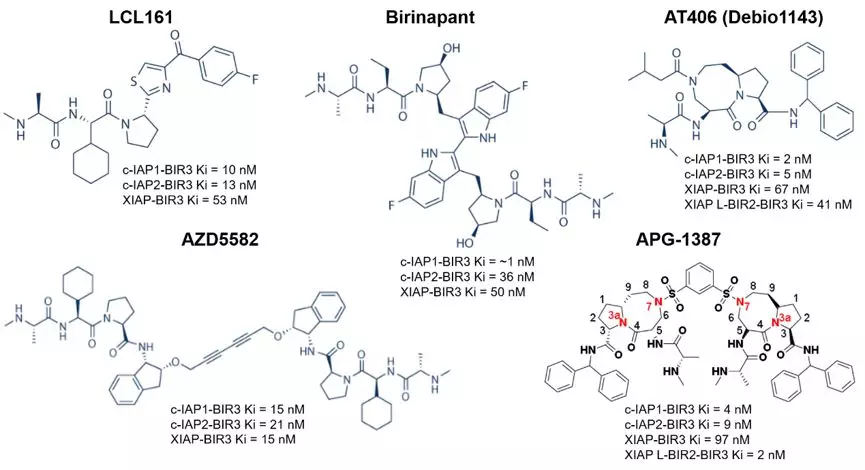
APG-1387:首箇中國原創IAP抑制劑
幾個IAP抑制劑中,除了前面提到的AZD5582之外,還格外值得關注的是APG-1387。該抑制劑由國內企業亞盛醫藥(06855.HK)自主研發,是我國1類原創新藥,也是中國首個進入臨牀的IAP抑制劑,在中國和澳大利亞都完成了I期研究,臨牀顯示耐受性良好,目前在美國正進行聯合PD-1單抗在腫瘤病人中的臨牀Ib/II期試驗,同時在中國正在進行乙肝(CHB)病人中的Ib試驗。
和其他諸多在研IAP抑制劑靶向的是IAP 蛋白單體的設計不同, APG-1387的主要優點在於其專為結合IAP蛋白二聚體而設,目前來看,此雙重抑法不論單獨使用或與其他標靶藥物(例如TKI)或 IO療法聯合使用,可提升其治療多種不同疾病的活性。APG-1387也是目前研發進程最為領先的雙體IAP抑制劑。
在臨牀前研究中,APG-1387與AZD5582表現非常相似。APG-1387已顯示出強效抗腫瘤活性,並能消除乙肝表面抗原。APG-1387擁有高效且有利的PD-PK特性,這令其能夠通過每週靜脈給藥實現癌症等疾病治療。作為高效的 IAP 蛋白抑制劑,APG-1387具有較高的親和力及較長的腫瘤組織半衰期,有成為Best in class的潛力。
根據亞盛去年10月招股書中披露的信息,已完成的I期APG-1387單藥爬坡臨牀研究結果提示:APG-1387單藥用於多線治療失敗的晚期實體瘤病人的安全性良好,尤其在美國的單藥研究中,11例療效可評估的經過多線治療的晚期胰腺癌患者,5例受試者評價為SD,疾病控制率為45.4%,其中1例45mg劑量患者獲得超過7個月的疾病穩定(最佳治療反應+6%),1例60mg劑量患者使用1次APG-1387,1個月後腫瘤評估顯示腫瘤縮小16.7%,並且維持超過8個月的臨牀獲益。
這些初期的單藥抗腫瘤的療效數據反映了APG-1387作為一種新型的雙價IAP(凋亡抑制蛋白)抑制劑具有抗腫瘤作用,並具有量效關係。另外,2019年在ESMO上公佈了Debio 1143對比安慰劑聯合同步放化療在局部高危晚期鱗狀細胞頭頸癌患者的雙盲隨機II期研究,達到主要終點。值得一提的是,Debio1143是由亞盛公司前身亞生公司開發後轉讓給瑞士Debio公司,原名AT-406,是一種單體IAP抑制劑,APG-1387是它的升級版,與它相比,對IAP靶點具有更強的結合力。
在聯合用藥的評估方面,12例接受 APG-1387聯合pembrolizumab治療的患者在第1週期未出現DLT。其中,在10例可評估患者中,1例已確認為PR(部分緩解),另有3例觀察到SD。一例過往接受多種治療且進展的晚期乳癌患者在6個治療週期後確認為PR(-79.3%),並正繼續進行治療。
APG-1387聯合抗PD-1單抗的II期臨牀試驗預計將在中國開始進行。同時,基於美國I期研究中探索到的針對晚期胰腺癌積極的療效信號,APG-1387聯合化療的II期研究也預計將在中國開展。
APG-1387還在拓展乙肝的適應症,正在中國進行Ib期研究。其研究數據顯示,12例患者在四次治療後,與基線值相比,12例患者中有10例HBV-DNA水平下降,12例患者中有8例HBsAg水平下降。其中6例患者HBV-DNA水平和HBsAg水平同時下降。初步數據顯示APG-1387於患者體內的抗病毒及免疫調節活性,有可能作為該等患者的功能性治療。事實上,不少IO類藥物其實也在探索乙肝適應症方面的應用,但目前真正進入臨牀的並不多。
結語
2019-nCov危害四方,牽動人心,其漫長的潛伏期已着實令人揪心。更值得警惕的是,有報道指出,疑似已有兩次核酸診斷轉陰的患者,在出院後再度復發。這種潛伏再復發的狀況,對病毒,尤其同為RNA病毒的HIV,其實並不罕見。Nature近期發表的這篇IAP抑制劑,已經為HIV治療提供了shock and kill的新思路。
雖然HIV的“shock and kill”治療策略在很大程度上仍然是一個理論概念,但是,AZD5582等IAP抑制劑是一種極有希望的潛伏期逆轉方法,結合系統清除HIV 感染的療法,將大大增加了根除 HIV 的機會,達到治癒艾滋病的目的。如有可能,希望這個全新發現,也能為剋制2019-nCov貢獻一份力量,早日平息肆虐橫行的疫情。
參考文獻:
[1] Systemic HIV and SIV latency reversal via non-canonical NF-κB signalling in vivo. http://Doi.org/10.1038/s41586-020-1951-3




