格隆匯11月7日丨金斯瑞生物科技(01548.HK)宣佈,公司的附屬公司傳奇生物科技有限公司將在2019年12月7日及2019年12月9日的美國血液學會(ASH)會議上發表LCAR-B38M和JNJ-68284528(JNJ-4528)的關鍵臨牀進展,包括在中國進行的LEGEND-2研究的長期隨訪臨牀研究,以及基於首次人體試驗的LEGEND-2臨牀研究在美國進行的CARTITUDE-1臨牀研究的初始資料。
LCAR-B38M和JNJ-68284528(JNJ-4528)是正在試驗中的用於複發性和╱或難治性多發性骨髓瘤(“RRMM”)的B細胞成熟抗原(“BCMA”)的嵌合抗原受體T細胞(“CAR-T”)治療。上述臨牀研究的資料摘要將在以下日期和時間發佈。CARTITUDE-1臨牀研究的最新資料將在口頭報告中發佈。
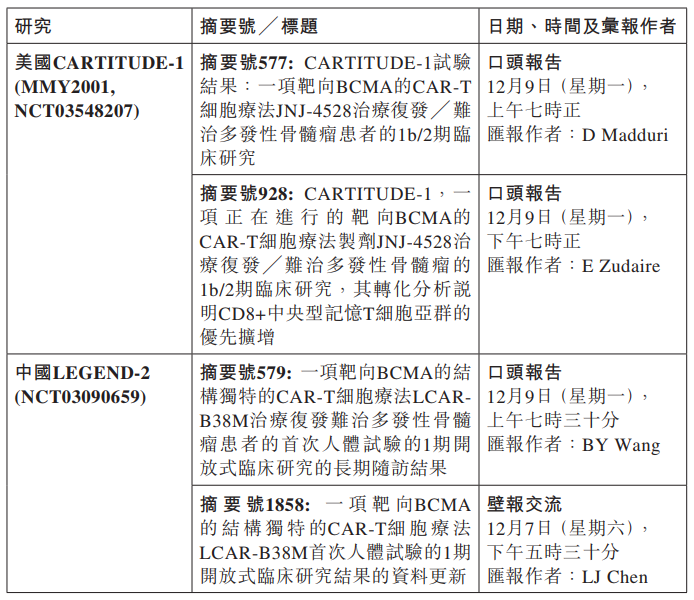
2019年2月,美國食品藥品監督管理局的罕見藥產品開發辦公室審批通過JNJ68284528(JNJ-4528)╱LCAR-B38M罕見藥。2019年4月3日,歐洲藥品管理局(European Medicines Agency,“EMA”)已授予Janssen-Cilag International N.V.的JNJ-4528藥物以優先審評藥物認定(PRIority MEdicines,“PRIME”)。該項認定有1b/2期的CARTITUDE-1臨牀研究(NCT03548207)和1/2期的LEGEND-2臨牀研究(NCT03090659)評估LCAR-B38M在復發╱難治多發性骨髓瘤患者中的結果作為支持。
公告顯示,LEGEND-2 (NCT03090659)是一項正在進行的單臂、開放式1/2期臨牀研究,在中國參與研究的4間醫院中共有74名受試者,評估LCAR-B38M治療復發╱難治性多發性骨髓瘤的療效和安全性。
在美國,1b/2期CARTITUDE-1 (MMY2001,NCT03548207)註冊研究正在研究JNJ-4528用於治療先前至少已經接受過3線治療或對蛋白酶抑制劑(“PI”)和一種免疫調節藥物(“IMiD”)有雙重耐藥性,且接受過一種PI、一種IMiD和抗CD38抗體治療,並且在開始接受最近一次治療的12個月內有疾病進展記錄的多發性骨髓瘤患者。




