本文來自:天風研究,作者:楊松、徐曉欣
報吿摘要
“疫苗+檢測+治療藥”閉環逐步形成,新冠疫情走向常態化
新冠疫情短期或不會消失,中長期防控閉環基本形成。中國實行動態清零策略,採取①疫苗接種建立免疫屏障、②通過核酸檢測快速確診患者、③使用多類藥物開展治療等多種方式。從投資角度,新冠產業鏈的驅動要素主要是國內和國外防控策略的變化以及產品供給端的進展,從防控政策方面看,全球各國正在推進新冠疫苗加強針的接種,海外國家主要以抗原檢測為主,強制免費檢測逐漸取消,中國抗原檢測還未放開,新冠口服藥尚未大規模應用於臨牀治療。從供給方面看,目前中國的新冠檢測試劑盒(核酸和抗原)、國內外疫苗的產能基本可以滿足全球的需求,主要缺口在新冠口服藥。
新冠抗原檢測或成為中國疫情防控重要補充手段
根據最新表態“完善常態化防控和突發疫情應急處置機制,突出口岸地區疫情防控這個重點,守住不出現疫情規模性反彈的底線”。我們認為中國抗原檢測或將成為疫情防控的重要補充手段,主要基於以下3點:1.國內抗原檢測產品成熟,靈敏度可達90%;歐洲抗原檢測已經實行了超過一年,對於疫情防控得到了驗證。2.產品產能足夠供應,2021年中國累計向海外出口668.93億元金額的新冠檢測試劑盒,企業擴產的週期較短。3.特定的應用場景需要抗原檢測快速反應,例如港口、機場、海運等場所為高風險感染新冠病毒的場所,外賣員、出租車司機等流動人員為高風險傳播源,這些場所和人羣若感染新冠病毒擴散較廣,疫情容易快速散播,每日進行核酸成本較高且檢測速度較慢,抗原檢測或提供較為便捷的管控。
中國新冠疫苗加強針接種將加速,序貫接種和同源接種同步推進
截至2022年2月25日,疫苗接種總人數為12.69億,,已完成第三針加強免疫接種人數約5.54億,未來第三針加強新冠疫苗接種需求約6.80億人,佔完成基礎免疫的55%。目前序貫接種和同源接種一樣為免費接種,優先在口岸、邊境等重點地區實行,其他人羣根據需要開展序貫加強免疫接種,我們預計第三針新冠疫苗各廠商將處於競爭狀態。
新冠口服藥供不應求,國產產品正在臨牀試驗
目前已有2款新冠口服藥獲批上市包括默沙東Molnupiravir以及輝瑞的Paxlovid。新冠口服藥的供不應求,輝瑞正在積極提升產能,根據輝瑞2021年年報數據,預計2022年上半年Paxlovid產量將達3千萬療程,下半年預計為9千萬療程,全年為1.2億療程。據默沙東公吿,截至2021年底已生產1000萬療程Molnupiravir,預計2022年將生產至少2000萬療程Molnupiravir。中國國產新冠藥物RdRp抑制劑已經進入臨牀3期試驗,包括君實生物、真實生物等;國產3CLpro抑制劑還處於研發早期,目前有前沿生物(注射劑)進入臨牀1期。
投資建議:
新冠疫情預計中長期與人類共存,疫情走向不確定因素較高,建議從三個維度篩選主題投資機會:1)需求持續性好,2)競爭格局較優,3)傳統業務具備估值一定支撐。建議關注相關標的:
1)新冠抗原檢測:東方生物、萬孚生物、安旭生物、博拓生物、奧泰生物;
2)疫苗加強針:智飛生物、康希諾、康泰生物;
3)新冠藥:君實生物、以嶺藥業;
4)CDMO供應鏈:藥明康德、凱萊英、博騰股份。
風險提示
新冠病毒變異風險、新冠抗原檢測放開不及預期、新冠疫苗接種不及預期、新冠藥物研發不及預期、新冠藥製備工藝存在不確定性為分析師主觀預計、新冠藥產業鏈公司參與存在不確定性等。
正文
1. 新冠防控新形勢下,抗原或為重要的檢測補充手段
1.1. 海外抗原檢測應用已成熟,中國或將逐步完善防控手段
目前海外新冠檢測以抗原檢測為主。新冠檢測的方法包括核酸、抗原和抗體,其中核酸檢測為金標準,但需要專業的PCR儀器檢測,等待時間較長;抗原檢測適用於檢測患病7天內的患者,反應速度較快,但靈敏度低於核酸,且存在假陰性的結果;抗體檢測主要通過檢測IgM或者IgG,判斷是否感染過新冠病毒,但無法檢測新冠病毒感染早期的人羣,抗體檢測存在窗口期。目前中國主要以核酸檢測為主,海外歐美髮達國家主要以抗原檢測為主。2020年4月英國開始向公眾提供免費抗原檢測,12月15日美國FDA批准第一個抗原自檢試劑盒上市,11月1日澳大利亞開始進行新冠抗原居家自檢。2021年全球疫情第二波爆發後,3月6日德國首先開始出售新冠抗原自檢試劑盒,每人每週可免費接受一次檢測。


抗原檢測靈敏度低於核酸,在大流行下可快速檢出,助力疫情防控。根據Science的研究,新冠患病率對於抗原檢測的效果不同,當人羣中新冠患病率下降時,抗原檢測試劑盒的假陽性人數上升,假陰性人數下降。斯洛伐克使用抗原檢測普檢的初期,新冠患病率高達3.9%,根據Pavelka的統計模型,抗原檢測普篩和其他疫情防控措施降低了70%疫情傳播。

抗原檢測產品較多,靈敏度為產品性能判斷的核心指標。根據不完全統計,目前歐盟CE認證的中國抗原檢測產品共有94個,美國EUA有3個產品,新冠抗原檢測拿證產品較多,判斷產品優劣的指標主要是靈敏度,即假陰性,核酸檢測的靈敏度在99%。根據Hvidovre Hospital對不同抗原檢測試劑盒和大量的樣品研究測試研究顯示,靈敏度超過90%的抗原檢測試劑共有9種,佔比不到20%,靈敏度最低的僅有2.5%,其中艾康生物生產的新冠快檢試劑的靈敏度高達94%,萬孚生物和LumiraDx的靈敏度均為93%。
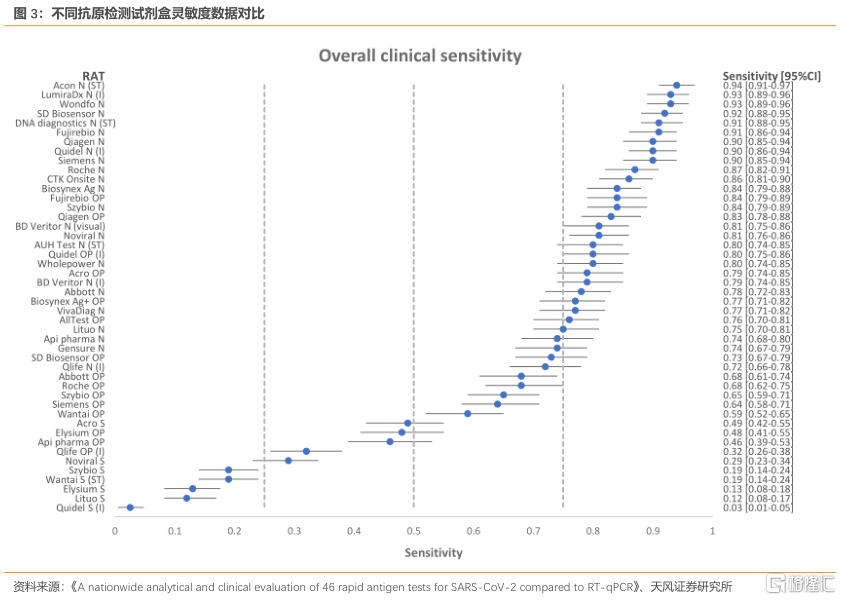

抗原檢測或為中國新冠疫情防控的重要補充。我們認為抗原檢測或逐步放開,主要基於以下3點:1.抗原檢測產品成熟,靈敏度可達90%;歐洲抗原檢測已經實行了超過一年,對於疫情防控得到了驗證。2.產品產能足夠供應,2021年中國累計向海外出口668.93億元金額的新冠檢測試劑盒,企業擴產的週期較短。3.特定的應用場景需要抗原檢測快速反應,例如港口、機場、海運等場所為高風險感染新冠病毒的場所,外賣員、出租車司機等流動人員為高風險傳播源,這些場所和人羣若感染新冠病毒擴散較廣,疫情容易快速散播,每日進行核酸成本較高且檢測速度較慢,抗原檢測或提供較為便捷的管控。
1.2.未來抗原自檢市場:海外跟蹤疫情確診,中國跟蹤政策放開
回顧2021年全年海外新冠檢測需求量較大,目前逐漸放開檢測量或下降。根據2021年全年檢測量看,海外大部分國家平均每千人每日檢測量在2-5次左右,疫情嚴重檢測需求較大,秋冬季節(1-3月、10-12月)顯著增加主要是由於新冠病毒變異導致感染人數增加。英國新冠檢測從2020年4月開始免費檢測,2021年全年平均每千人每日檢測量約13.67次,全年新冠檢測需求較高約3.31億人份。2022年4月1日英國將取消新冠檢測免費,新冠檢測的需求或下降。目前海外檢測要求放開,以英國為代表的國家檢測需求量在下降,未來檢測需求量增加主要變量是新冠疫情的嚴重程度,單日確診人數激增,檢測政策或發生改變。


海外市場中美國需求量較大壁壘較高,中國抗原自檢試劑盒尚未獲批。根據2021年平均每千人每天檢測量在2-5次,中性假設2022年平均每千人每天檢測3次,美國市場全年檢測需求約3.24億人份、歐洲市場約4.84億人份,海外市場約65.88億人份。新冠檢測持續性主要是看新冠病毒的變異情況,Omicron病毒引起全球新冠疫情又一次大流行,檢測需求激增。

2. 新冠疫苗加強針接種或將加速
2021年10月3日中國開始啟動新冠疫苗加強針免費接種,針對接種國藥中生北京公司、北京科興公司、國藥中生武漢公司的滅活疫苗和康希諾的腺病毒載體疫苗滿6個月的18歲以上的人羣可選擇接種一劑相同的疫苗,為同源接種。2022年2月19日國家聯防聯控批准部署序貫加強免疫,即異源接種,針對已接種國藥中生北京公司、北京科興公司、國藥中生武漢公司的滅活疫苗滿6個月18歲以上的人羣可以選擇接種一劑智飛生物的重組蛋白疫苗或康希諾的腺病毒載體疫苗。序貫加強的組合有兩種,分別為“滅活疫苗(2針)+重組蛋白疫苗(1針)”和“滅活疫苗(2針)+腺病毒載體疫苗(1針)”。

目前在海外已經有10個國家或地區批准進行異源加強,其中阿根廷和智利使用腺病毒載體疫苗進行加強免疫,印尼使用重組蛋白新冠疫苗進行加強免疫。

2.1.臨牀試驗顯示接種“加強針”中和抗體水平顯著提升
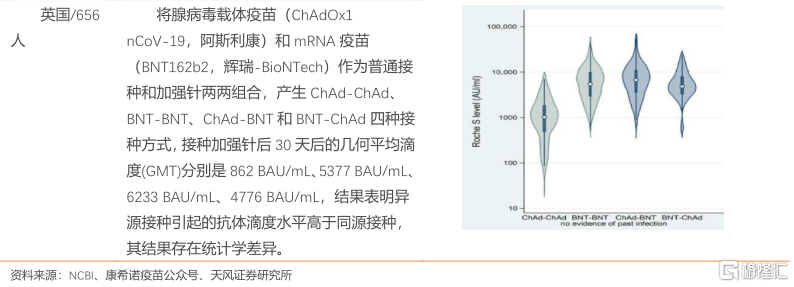
多項臨牀研究針對疫苗同源加強和/或異源加強進行分析,同源加強和異源加強均提升中和抗體水平,且部分研究顯示異源接種引起的中和抗體滴度水平高於同源接種。



2.2. 中國加強免疫接種仍為免費接種,預計需求約6.80億人
根據wind,截至2022年3月4日中國累計接種新冠疫苗約31.52億劑次,截至2022年2月25日,疫苗接種總人數為12.69億,其中完成全程接種12.34億人,已完成第三針加強免疫接種人數約5.54億,未來第三針加強新冠疫苗接種需求約6.80億人,佔完成基礎免疫的55%。目前序貫接種和同源接種一樣為免費接種,優先在口岸、邊境等重點地區實行,其他人羣根據需要開展序貫加強免疫接種,我們預計第三針新冠疫苗各廠商將處於較為激烈的競爭狀態。

3. 新冠口服藥供不應求,國產產品正在臨牀試驗
目前已有2款新冠口服藥獲批上市包括默沙東Molnupiravir以及輝瑞的Paxlovid。默沙東Molnupiravir已在英國、美國和日本等獲得許可/緊急使用授權。近日,Molnupiravir獲得WHO的推薦建議用於治療高住院風險的輕症新冠患者。Molnupiravir的EUA申請是基於3期MOVe-OUT臨牀試驗。在接受Molnupiravir治療的患者中接受Molnupiravir治療的患者在第29天住院或死亡率為7.3%(vs14.1%),在所有隨機受試者中相對風險降低幅度為30%。輝瑞的Paxlovid已在英國、加拿大、美國和日本等獲得批准/緊急使用授權,2022年2月獲得中國附條件獲批進口註冊。在II/III期EPIC-HR試驗(NCT04960202)中,Paxlovid使5天內出現症狀並接受治療的患者因任何原因住院或死亡的風險降低了88%,接受治療的患者中在28天隨訪期間住院或死亡的概率由6.3% 降至0.8%,整體死亡率由1.1%下降至0。
此外,日本鹽野義的口服新冠藥S-217622已基於IIb期臨牀數據向PMDA提交有條件批准申請。IIb期臨牀結果顯示S-217622能快速降低病毒滴度和病毒RNA,在S-217622治療組中病毒滴度陽性的受試者比例下降了約60-80%,新型冠狀病毒病毒滴度陰性的平均時間縮短了2天,同時也展現了良好的安全性。

由於新冠口服藥物療效明確、服用方便、可及性強,已逐漸成為各國政府抗疫採購主流趨勢。從美國政府新冠藥物採購數據可以看出,自新冠口服藥上市後,美國政府採購抗體藥物數量趨勢下降,新冠口服藥物採購趨勢明顯上漲。據各國政府報道,針對輝瑞Paxlovid,美國、英國、日本已分別累計採購2000萬、275萬、200萬療程;針對默沙東Molnupiravir,美國、英國、日本已分別累計採購950萬、230萬和160萬療程。

3.1.輝瑞Paxlovid供應鏈
目前輝瑞Paxlovid已在美國、歐盟和中國等全球多個國家上市,為擴大全球藥品可及性,輝瑞正在積極提升產能,根據輝瑞2021年年報數據,預計2022年上半年Paxlovid產量將達3千萬療程,下半年預計為9千萬療程,全年為1.2億療程,Paxlovid全年銷售額預計為220億美元。
Paxlovid是Nirmatrelvir與Ritonavir的複方製劑,其中Ritonavir為已上市藥物利托那韋,Nirmatrelvir為新冠病毒3CL蛋白酶抑制劑的新分子實體。Nirmatrelvir的生產工藝路線與供應鏈體系均需重新構建,所涉供應鏈包括CDMO與醫藥中間體供應商。我們認為未來隨着Paxlovid的全球範圍獲批與MPP協議的全球銷售,相關供應鏈訂單需求量可觀且有望保持擴張。
3.1.1. Nirmatrelvir CDMO供應鏈
新冠口服藥物強勁需求或將催生優質原料藥供應需求。Paxlovid的服用方式為每日兩次(間隔12小時),每次三片(兩片150mg“Nirmatrelvir”和一片100mg“Ritonavir”),一個療程需服用五天。按照目前輝瑞2022年計劃供應1.2億療程來計算,不考慮原料消耗,Nirmatrelvir原料藥的需求為360噸,Ritonavir原料藥的需求為120噸,全球市場對Paxlovid的強勁需求或將催生優質原料藥快速供應的需求。
在全球外包產能需求旺盛的背景下,國內CDMO公司的領先技術、充足產能、國際化合規體系與IP保護,以及全球突發事件中體現的穩定供應與交付效率,為國內CDMO公司帶來更多機遇。國內凱萊英、博騰股份等CDMO公司已公吿獲得大額訂單,凱萊英分別於2021年11月17日、2021年11月29日公吿4.81億美元、27.20億元訂單,博騰股份分別於2021年11月30日、2022年2月11日公吿2.17億美元、6.81億元訂單,訂單供應時間截至2022年。重磅訂單的獲得充分凸顯國內CDMO公司在全球範圍內的綜合競爭力,為後續更多優質訂單的獲取樹立品牌效應,助力國內CDMO公司加速產業轉型升級,獲得更長遠的生命力。

3.1.2. Nirmatrelvir中間體供應鏈
輝瑞Paxlovid在全球範圍內的獲批有望帶動上游中間體產業鏈。根據輝瑞在Science發表的文章,推測Nirmatrelvir的工藝路線由3個片段分別生產後拼接合成,整個生產路線中涉及多箇中間體化合物的供應。輝瑞已與藥品專利池(MPP)簽署Paxlovid許可協議,獲得MPP授權的合格仿製藥生產商將為95個國家提供Paxlovid,覆蓋全球53%人口。中國作為全球最大的醫藥中間體/原料藥生產和出口地區,在全球醫藥產業鏈佔據重要地位,國內原料藥企業具備Nirmatrelvir從原料-中間體-原料藥的全產業鏈供應能力,隨着Paxlovid的多國獲批與MPP協議的全球銷售,Nirmatrelvir合成路線所涉中間體/原料藥的訂單需求有望進一步擴大。


3.1.3. 利托那韋供應鏈
Ritonavir為已上市藥物利托那韋,利托那韋是一款抗艾滋病毒藥物,原研藥企業為Abbvie,Abbvie於2020年3月23日放棄利托那韋全球專利權,以面對可能威脅全球的藥物供應短缺問題。據國家藥品監督管理局(NMPA)信息,截至目前,國內共有四家企業獲批生產利托那韋:歌禮藥業(浙江)有限公司、上海迪賽諾化學制藥有限公司、萬全萬特製藥(廈門)有限公司、廣東東陽光藥業有限公司。據各公司公吿,歌禮藥業利托那韋口服片劑年產能已擴大至1億片,未來根據市場需求可進一步快速擴大;精華製藥(森萱醫藥)、海特生物均具有成熟的利托那韋片關鍵中間體生產技術。

3.2. 默沙東Molnupiravir供應鏈
默沙東Molnupiravir於2021年11月4日在英國獲批上市,2021年12月23日獲得美國FDA緊急使用授權,2021年銷售額為9.52億美元。截至2022年2月19日,默沙東已向20多個獲得批准上市或使用授權的國家/地區交付Molnupiravir,已與聯合國兒童基金會達成協議,2022年上半年將向中低收入國家調配總計300萬療程。
供應規模提升拉動供應鏈需求擴張。據默沙東公吿,截至2021年底已生產1000萬療程Molnupiravir,預計2022年將生產至少2000萬療程Molnupiravir。Molnupiravir的服用方式為每日兩次(間隔12小時),每次4片(200mg/片),一個療程需服用五天。按照目前默沙東2022年計劃供應2000萬療程來計算,不考慮原料消耗,對Molnupiravir原料藥的需求為160噸。

默沙東在ACS Central Science發表的論文表明,該研究團隊以核糖為原料,採用工程激酶Ribosyl-1激酶和尿苷磷酸化酶,開發三步法合成路線,新合成路線比原胞嘧啶起始路線總產率提高7倍。據公司公吿,天宇股份為默沙東Molnupiravir提供中間體CMO服務。
默沙東與藥品專利池組織(MPP)達成協議,增加Molnupiravir在105個國家的供應,2022年1月20日MPP宣佈,與27家仿製藥製造公司簽訂協議將為全球105箇中低收入國家或地區生產及供應Molnupiravir仿製藥,其中有5家中國藥企入圍協議名單,復星醫藥、博瑞醫藥、龍澤製藥與迪賽諾獲許可同時生產Molnupiravir原料藥和製劑,維亞生物旗下朗華製藥獲許生產Molnupiravir原料藥。隨着Molnupiravir的全球推廣與MPP協議的全球銷售,Molnupiravir市場有望進一步打開。
3.3. 國產新冠藥物正在臨牀試驗
3.3.1. 國產新冠藥RdRp抑制劑進展
RdRp抑制劑的主要作用機理是通過阻斷RNA聚合酶(RdRp)的合成來阻斷冠狀病毒。目前中國多家藥企積極開展新冠口服藥研發佈局,其中君實生物、真實生物已進入III期臨牀試驗階段。君實生物VV116已獲得烏茲別克斯坦緊急使用授權(EUA),VV116已於中國完成的I期臨牀研究以及此前於烏茲別克斯坦針對中重度患者進行的臨牀研究均顯示出其符合預期的安全性和有效性。目前正在開展一項國際多中心III期試驗,輕中症患者試驗計劃入組2000人。另一款RdRp抑制劑真實生物的阿茲夫定正在中國、巴西及俄羅斯分別開展III期試驗,其中,在巴西開展的針對中重度新冠肺炎患者的III期試驗 (NCT04668235)預計在2022年4月完成,針對輕症患者試驗(NCT05033145)預計2022年7月完成。歌禮制藥ASC10計劃於2022年H1在中美等地進行IND申報。

3.3.2. 國產新冠藥3CLpro抑制劑及其他類型藥物進展
3CL 蛋白酶抑制劑能抑制3CL蛋白酶的活性,阻斷冠狀病毒的複製過程,在治療新冠病毒感染方面具有顯著優勢。前沿生物、君實生物及先聲藥業等多家藥企佈局與輝瑞Paxlovid同機制的3CLpro抑制劑研發,目前除前沿生物(FB2001,注射劑)進入I期試驗外,其他藥企尚處於臨牀前研究階段。據君實生物投資者關係記錄,根據VV993的臨牀前研究和抗病毒研究數據,VV993單藥即顯示出良好的有效性和安全性。先聲藥業的SIM0417在動物模型中顯示了良好的抗病毒活性和安全性;廣生堂發佈公吿稱其獲得具有相當藥效的預選臨牀前候選化合物;雲頂新耀授權引入新加坡A*ccelerate的新冠口服藥EDDC-2214,預計於2022年開展臨牀試驗;歌禮制藥ASC11計劃於2022年H2在中美等地進行IND申報。
開拓藥業的雄激素受體拮抗劑普克魯胺則在烏拉圭獲批EUA,但其針對輕中症非住院患者的III期試驗中期分析未達到終點。目前公司正在開展重症住院患者的III期臨牀研究,以及輕中症全球III期臨牀試驗。2月14日,治療輕中症新冠全球III期臨牀試驗完成中國首例受試者給藥。

4. 投資建議
新冠疫情預計中長期與人類共存,疫情走向不確定因素較高,建議從三個維度篩選主題投資機會:1)需求持續性好,2)競爭格局較優,3)傳統業務具備估值一定支撐。相關標的:
1)新冠抗原檢測:東方生物、萬孚生物、安旭生物、博拓生物、奧泰生物;
2)疫苗加強針:智飛生物、康希諾、康泰生物;
3)新冠藥:君實生物、以嶺藥業;
4)CDMO供應鏈:藥明康德、凱萊英、博騰股份。
5. 風險提示
1) 新冠病毒變異風險;新冠病毒如果發生變異,全球有可能引發再一次大流行,各國政府防疫政策或有所改變,檢測、疫苗、治療藥的需求不確定性較高。
2) 新冠抗原檢測放開不及預期;中國新冠抗原檢測不放開,抗原檢測相關的公司無法在中國銷售,業績會有一定的影響。
3) 新冠疫苗接種不及預期;中國新冠疫苗加強針接種不及預期,免疫屏障或無法建立,防疫政策或無法放開。
4) 新冠藥產業鏈公司參與存在不確定性。梳理產業鏈公司僅代表公司存在相關產品的生產能力,不代表我們認為相關公司已參與或將參與新冠藥產業鏈。
5) 新冠藥物研發不及預期;
6) 新冠藥製備工藝存在不確定性,為分析師主觀分析。
報吿來源:天風證券股份有限公司
報吿發布時間:2022年3月8日
本資料為格隆匯經天風證券股份有限公司授權發佈,未經天風證券股份有限公司事先書面許可,任何人不得以任何方式或方法修改、翻版、分發、轉載、複製、發表、許可或仿製本資料內容。
免責聲明:市場有風險,投資需謹慎。本資料內容和意見僅供參考,不構成對任何人的投資建議(專家、嘉賓或其他天風證券股份有限公司以外的人士的演講、交流或會議紀要等僅代表其本人或其所在機構之觀點),亦不構成任何保證,接收人不應單純依靠本資料的信息而取代自身的獨立判斷,應自主做出投資決策並自行承擔風險。根據《證券期貨投資者適當性管理辦法》,若您並非專業投資者,為保證服務質量、控制投資風險,請勿訂閲本資料中的信息,本資料難以設置訪問權限,若給您造成不便,還請見諒。在任何情況下,作者及作者所在團隊、天風證券股份有限公司不對任何人因使用本資料中的任何內容所引致的任何損失負任何責任。本資料授權發佈旨在溝通研究信息,交流研究經驗,本平台不是天風證券股份有限公司研究報吿的發佈平台,所發佈觀點不代表天風證券股份有限公司觀點。任何完整的研究觀點應以天風證券股份有限公司正式發佈的報吿為準。本資料內容僅反映作者於發出完整報吿當日或發佈本資料內容當日的判斷,可隨時更改且不予通吿。本資料內容不構成對具體證券在具體價位、具體時點、具體市場表現的判斷或投資建議,不能夠等同於指導具體投資的操作性意見。




