本文來自格隆匯專欄:國泰君安證券研究,作者:趙子健
十九世紀以來,全球的生物製藥工業經歷了小分子藥物和蛋白類藥物兩大浪潮,但二者的研發受到靶點可成藥性的限制。隨着新靶點的研發難度日益增大,創新的小分子和蛋白類藥物的開發難度也不斷增加。
小核酸藥物則是以核酸為靶標,通過對蛋白翻譯過程的調控來實現疾病治療,具有靶點豐富、研發週期短、藥效持久、臨牀開發成功率高等優勢。經過四十年餘年的研究積累,小核酸藥物在化學修飾、藥物遞送方面不斷取得進展。近兩年,小核酸藥物呈現加速獲批態勢,特別是疫情期間,新冠mRNA疫苗在研發效率和藥物療效方面所展現的優越性讓人們看到了核酸藥物的巨大潛力。
未來,具備平台屬性的小核酸藥物的治療領域將不斷拓展,有望引領第三次現代製藥的浪潮。通過修飾方法和遞送系統的優化,進一步提升藥物穩定性和生物利用度、降低毒副作用是小核酸藥物開發的關鍵所在,擁有修飾和遞送核心技術平台的企業值得重視。
導讀:
靶點的“可成藥性”在一定程度上限制了小分子和蛋白類藥物的創新發展,而小核酸藥物以核酸序列為靶標,極大地拓展的靶點範圍,有望引領下一個創新制藥浪潮。具備核酸化學修飾和藥物遞送等核心技術的企業將在行業發展中脱穎而出。
一、 小核酸藥物:調控蛋白翻譯,突破“不可成藥”限制
1.1
核酸藥物通過調控病蛋白翻譯實現疾病治療
人類很多疾病的發生都與蛋白質的結構、功能和數目變化密切相關,而人體內蛋白質的合成均遵循中心法則。中心法則是指遺傳信息從DNA傳遞給RNA,再從RNA傳遞給蛋白質的轉錄和翻譯過程,以及遺傳信息從DNA傳遞給DNA的複製過程。根據中心法則,蛋白質的合成受到核酸的指導和控制。隨着分子生物學的發展,研究者還發現,儘管有些 DNA/RNA 並不被轉錄/翻譯為蛋白質,但對轉錄/翻譯過程起着重要的調控作用,如DNA中的啟動子、增強子, RNA中的核酶、微小RNA(miRNA) 、小干擾RNA(siRNA) 、小激活RNA(saRNA)等。因此,人們也開始在核酸層面進行藥物設計,小核酸藥物即是通過直接作用於與致病蛋白相關的RNA,調控蛋白的合成,進而達到治療疾病的目的。狹義的小核酸是指siRNA,而廣義的小核酸則涵蓋了siRNA、反義寡核苷酸(ASO)、miRNA、saRNA、信使RNA(mRNA)、適配體(Aptamer)等一系列能參與轉錄後基因表達調控的小核酸。小核酸藥物實現疾病治療的思路主要有兩條:一方面,可以針對細胞內的mRNA、非編碼RNA(ncRNA)等,通過基因沉默抑制蛋白的表達從而實現疾病治療;另一方面,對於由蛋白缺乏導致的疾病,也可引入saRNA上調目標基因的表達,或引入mRNA表達所需的蛋白,進行蛋白替代治療。
圖1 中心法則及各類藥物主要針對的靶點

資料來源:國泰君安證券研究
表1 各類常見的RNA及其功能

資料來源:《RNA種類、結構及功能的多樣性》,國泰君安證券研究
1.2
擴大靶點範圍,小核酸藥物差異化優勢顯著
小核酸藥物是與小分子藥物、抗體藥物完全不同的全新藥物類型,其作用機理、研發模式、生產工藝、藥代藥效特徵等性質均與小分子和抗體藥存在較大差異,這些差異也賦予了小核酸藥物顯著的差異化競爭優勢。與目前主流的小分子和抗體類藥物相比,小核酸藥物具有候選靶點豐富、研發週期短、藥效持久、特異性強、臨牀開發成功率高等優勢,其可針對難以成藥的蛋白靶點開發靶向上遊核酸層面的治療藥物,有望攻克尚無有效治療藥物的疾病。
(1)候選靶點豐富
小分子和抗體藥物均是通過與靶點蛋白結合發揮治療作用,因此,其開發難度很大程度上受靶蛋白成藥性的影響,諸如靶蛋白是否有合適的“口袋”結構等。根據Nature Reviews Drug Discovery的報道,在人類基因編碼的超過20000個蛋白質中,可成藥的蛋白僅有3000個,超過80%的蛋白質為非疾病相關蛋白或不能被目前常規的小分子藥物和生物大分子藥物所靶向的蛋白,屬於不可成藥靶點;在可成藥的3000個蛋白中,目前也僅有 700個蛋白質相對應的治療藥物被成功研發出來。隨着新靶點的開發難度越來越高,小分子藥物和抗體藥物的研發難度也不斷提升,而成熟靶點相關的藥物賽道將變得日益擁擠。
小核酸類藥物是基於鹼基互補配對原理,通過干擾翻譯過程實現對基因表達的調控,無需與靶點蛋白質直接結合。因此,理論上任何由特定基因錯誤表達引起的疾病都可以通過小核酸藥物進行治療,這為小核酸藥物的開發提供了豐富的候選靶點,使其突破了傳統小分子化藥和抗體類藥物面臨的限制。
(2)研發週期短
DNA 測序技術的發展和成熟使得疾病相關的基因序列信息能夠快速、準確地獲取,而在知道靶基因的序列之後,即可進行小核酸藥物的序列設計。這種主動的、明確的、有針對性的藥物設計擺脱了傳統藥物的大規模篩選週期,大大縮短了藥物開發的時間。以此次新冠疫情中Moderna公司mRNA疫苗的前期開發過程為例,COVID-19的核酸序列於2020年1月11日公佈,Moderna在1月13日即完成mRNA疫苗序列的研究工作,2月7日完成首批樣品製備,3月3日開始I期臨牀,3月16日即完成了首例患者給藥,其前期開發速度遠高於傳統的疫苗。
(3)藥效持久
整體而言,小核酸藥物的有效作用時間比傳統的小分子和蛋白藥物更長。以siRNA藥物為例,當靶標mRNA被降解後, RNA誘導的沉默複合體(RISC)可以循環工作,參與下一輪靶標mRNA的降解。因此,小核酸藥物可在細胞內實現較長時間的藥效作用,降低給藥頻率,提高患者治療的依從性。較長的作用週期使得小核酸藥物在糖尿病、心血管疾病等慢性病領域具有競爭優勢。
(4)特異性強
傳統的小分子和抗體藥物與靶點的結合是結構驅動的,具有相似結構的蛋白質將影響藥物的特異性。而小核酸藥物與靶標的結合是序列驅動的,通過鹼基互補配對識別特定目標序列,具有最小的或至少可預測的脱靶效應。因此,小核酸藥物也具有相對更高的特異性。
(5)臨牀開發成功率高
小核酸藥物以明確的疾病相關的核酸序列為目標,其針對性的設計避免了研發過程的盲目性,使得研究結果的確定性更強,臨牀開發的成功率也更高。以小核酸藥物領域的龍頭企業Alnylam為例,其研發項目從I期臨牀進展到III期臨牀的開發成功率達到 59.2%,而根據《Clinical Development Success Rates 2006-2015》的統計,創新藥從I期臨牀進展到III期臨牀的平均成功率僅為11.2%。
圖2 小核酸藥物的研發成功率遠高於創新藥整體
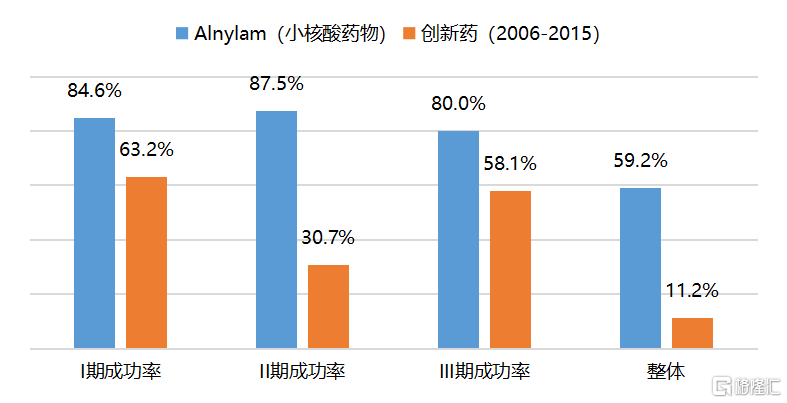
資料來源:Alnylam,《Clinical Development Success Rates 2006-2015》,國泰君安證券研究
表2 小核酸藥物與小分子藥物、抗體和基因治療藥物相比優勢明顯

資料來源:Sirnomics,國泰君安證券研究
二、多年曲折發展,小核酸藥物終迎發展新紀元
2.1
小核酸藥物經歷了曲折的發展過程
從1978年ASO的概念首次被提出,到如今小核酸藥物不斷商業化落地,其發展過程可分為三個階段:
(1)探索發現期(1970s-2005年)
1978年,哈佛大學科學家Paul Zamecnik等人首次利用ASO技術成功抑制了Rous肉瘤病毒的複製,拉開了小核酸藥物開發的序幕。1985年,硫代磷酸修飾方法的開發,提升了反義核酸的穩定性和遞送效率,同時RNase H依賴的反義核酸作用機制得到解析,推動了ASO藥物的臨牀應用進程。1998年,第一款ASO藥物獲批,同年,RNAi的作用機理被揭示,小核酸藥物研發熱情高漲,羅氏、默克、輝瑞、賽諾菲、雅培等巨頭紛紛進入這一領域。
(2)曲折發展期(2005-2016年)
這一時期,由於穩定性、免疫原性和遞送系統的問題,小核酸藥物的研發和商業化屢遭挫折。全球首個獲批的ASO藥物Vitravene因銷售額過低而退出市場;多個ASO藥物接連在臨牀研究中失敗;siRNA藥物也面臨體內不穩定性和潛在的免疫原性等問題。2009~2013年,小核酸藥物的發展陷入低谷,大型藥企和資本紛紛離場,諾華和羅氏中止了和Alnylam的合作,輝瑞和雅培也中止了RNA藥物的研究項目。2013年,全球第二個ASO藥物Mipomersen(針對用於治療純合子家族性高膽固醇血癥)的獲批,讓人們看到了行業復甦的希望。
(3)快速發展期(2016年-今)
隨着前期研發的積累,這一時期,小核酸藥物在化學修飾和遞送技術等領域取得關鍵性突破,小核酸藥物領域的龍頭企業也進入收穫期。2016~2018年,Ionis和Sarepta Therapeutics公司的多款ASO藥物相繼獲批。2018年,Alnylam公司開發的治療周圍神經病變的siRNA藥物Patisiran 獲FDA批准,成為全球第一個獲批的siRNA藥物。根據弗若斯特沙利文的數據,目前全球有近80個小核酸藥物進入臨牀研究階段,整個行業也進入了發展的新紀元。
圖3 小核酸藥物在曲折中發展

資料來源:弗若斯特沙利文
2.2
多款潛力藥物上市,資本和藥企加速佈局
2.2.1
潛力產品不斷獲批,市場規模高速增長
目前,全球共有14款小核酸藥物款獲批上市,包括4款siRNA、9款ASO、1款Aptamer,其中80%的產品為2015年以後上市,已上市小核酸藥物大部分所針對的適應症為遺傳性疾病。從競爭格局來看,Ionis、Alnylam和Sarepta是小核酸藥物三巨頭,三者獨立研發或與其他企業合作研發上市的產品多達12個,佔已獲批產品的比例達到86%。目前,國內企業尚無產品獲批上市。
表3 已上市的小核酸藥物彙總

資料來源:藥鏈圈,國泰君安證券研究
從全球幾款重磅小核酸藥物的銷售額來看,2019年全球小核酸藥物的市場規模已超過26億美元。由於目前上市的小核酸藥物主要適應症均為罕見病,患者羣體數量有限,因此其整體市場規模還相對較小。隨着針對代謝性疾病、感染、癌症等患者羣體的更廣泛適應症藥物不斷落地,未來幾年,小核酸藥物市場將快速增長,預計2025年全球小核酸藥物銷售額將突破100億美元。據藥鏈圈預測,2030年我國小核酸藥物市場規模也將突破100億元。
圖4 小核酸藥物競爭格局(獲批產品數量佔比)

資料來源:國泰君安證券研究
圖5 全球小核酸藥物市場規模快速增長(億美元)

資料來源:《RNA therapeutics on the rise》,國泰君安證券研究
2.2.2
在研管線快速跟進,適應症領域不斷拓寬
隨着修飾和遞送等關鍵問題的突破,小核酸藥物的開發效率迅速提升。據弗若斯特沙利文統計,截至2020年12月,全球進入臨牀階段的小核酸藥物研發管線接近80個,其中10個進入了臨牀III期,大多數集中在臨牀I期和II期;此外,全球還有超過400個小核酸藥物研發管線處於臨牀前研究階段。全球小核酸藥物開發企業可分為兩類:一類是以Ionis、Alnylam、Arrowhead、Sarepta、Dicerna等為代表的致力於小核酸技術研發和創新的公司,他們在成立時即專注於這一領域,經歷了長期的研發積累,擁有自主的核心技術平台,在產品研發進度和管線豐富程度上處於行業領先地位;另一類是以羅氏、阿斯利康、諾華、GSK等為代表的醫藥巨頭,由於具有雄厚的資金實力,出於效率方面考慮,更多是通過合作研發、授權引進等方式快速佈局這一領域。
圖6 全球臨牀階段的管線數目超80個

資料來源:弗若斯特沙利文,國泰君安證券研究
注:截至2020.12
圖7 Ionis、Alnylam、Arrowhead管線佈局領先
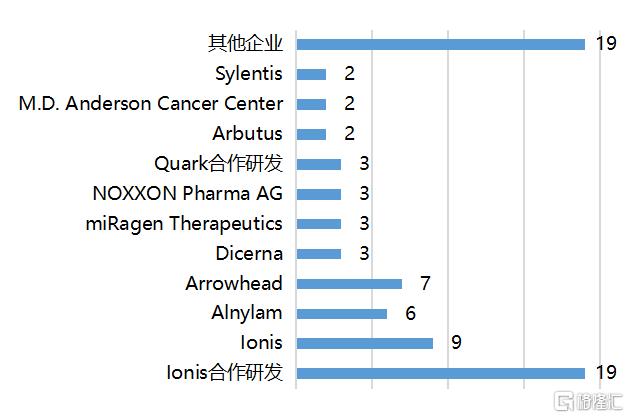
資料來源:弗若斯特沙利文分析,國泰君安證券研究
注:截至2020.12
表4 醫藥巨頭通過授權引進和合作研發快速進入小核酸領域(不完全統計)
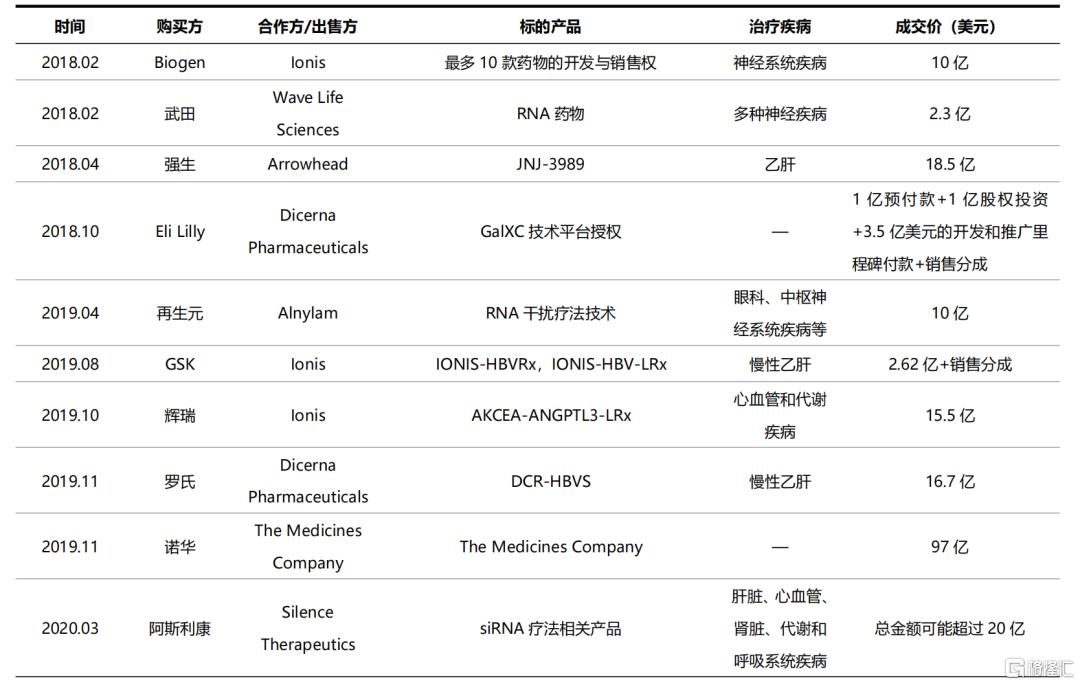
資料來源:國泰君安證券研究
目前,國內致力於小核酸藥物研發的創新型企業有十餘家。通過合作研發和自主開發相結合的方式,國內小核酸企業迅速成長。截至2021年7月,共有7款國內企業的在研小核酸藥物管線進入臨牀階段(不包括mRNA疫苗),其中3款ASO藥物、4款siRNA藥物。
表5 國內多家企業小核酸藥物管線進入臨牀(不包括mRNA疫苗)

資料來源:公司官網,國泰君安證券研究
從在研管線的治療領域統計數據來看,小核酸藥物的適應症正在不斷拓寬,重點治療領域包括杜氏肌營養不良、癌症、囊性纖維化等。其中,杜氏肌營養不良佔比達到25%,癌症佔比為10%,口腔修復科佔比為7%;其他治療領域,如神經系統疾病、代謝疾病、傳染病等也均有佈局。未來,隨着適應症領域的拓寬,特別是針對腫瘤、代謝疾病等大患者羣體的小核酸藥物落地,小核酸藥物市場將進入高速增長階段。
圖8:小核酸藥物治療領域不斷豐富

資料來源:華經產業研究,國泰君安證券研究
2.2.3
資本助力,加速小核酸藥物商業化進程
近年來,技術的突破、產品的陸續落地以及巨大的潛在市場空間使得小核酸藥物深受資本青睞。根據Wind數據,海外上市的小核酸藥物公司自2016年1月至2021年1月市值的平均增幅達到580%。2018年上市的Moderna 和2019年上市的BioNTech兩家mRNA疫苗研發企業市值亦呈爆發式增長,2021年8月底分別突破1600億美元和900億美元。
表6 小核酸藥物上市企業市值快速增長(不包含mRNA企業)
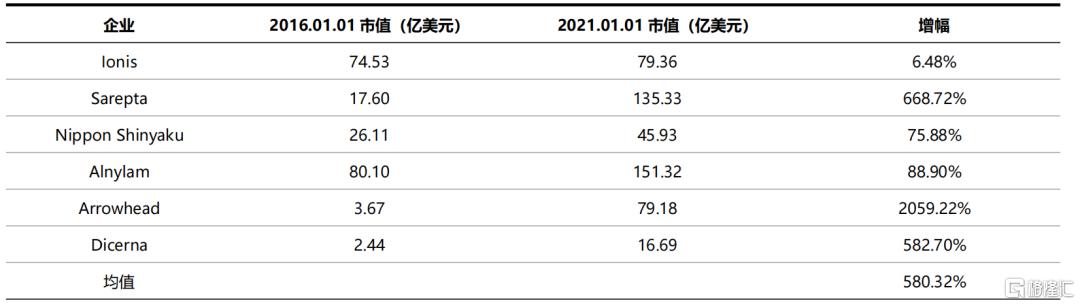
資料來源:Wind,國泰君安證券研究
在一級市場,小核酸藥物初創企業也不斷獲得大額融資。醫藥魔方數據顯示,2021年1~6月,全球RNA療法領域共發生28起投融資事件,總投資金額超10億美元,另有18項企業之間的項目和技術交易合作。儘管國內企業目前尚無產品獲批,但資本普遍看好該行業國內市場未來5~10年的增長潛力,知名機構紛紛佈局這一賽道。近兩年,國內小核酸領域投融資事件頻發。2021年上半年,國內至少9家小核酸藥物企業獲得投資,資本的助力將加速小核酸藥物的研發和商業化進程。
表7 國內小核酸創新企業2020~2021年頻獲大額投資

資料來源:Wind,醫藥魔方,國泰君安證券研究
三、不同機理均獲突破,多條路徑並駕齊驅
3.1
ASO藥物:發展迅速,獲批藥物最多
1978年ASO技術誕生後,ASO藥物發展迅速,無論是基礎科學研究還是商業化進程,均領先其他類型核酸藥物。從1998年首個ASO藥物獲FDA批准,到目前獲批的ASO藥物已達到9款,成為小核酸領域獲批藥物最多的一個類型。
3.1.1
ASO藥物作用機理
ASO是一種單鏈寡核苷酸分子(18~30nt),可以是DNA、RNA或DNA/RNA的雜合單鏈,進入細胞後可通過多種機制調節基因表達。ASO藥物包括RNase H依賴型與空間位阻型兩種機制:
(1)RNase H介導的RNA的降解
RNase H(核糖核酸酶H)是一種核糖核酸內切酶,內源性RNase H能夠特異性識別並切斷雜交到DNA鏈上的RNA的磷酸二酯鍵,即能特異性降解RNA-DNA雜交鏈中的RNA鏈,進而沉默靶基因的表達。經典的RNase H依賴型ASO藥物通常遵循Gapmer模式,即一個基於DNA的中央“間隙”被基於RNA的側翼區域包圍(如下圖a所示),ASO中DNA序列和靶序列結合後即可招募RNase H介導RNA的降解。由於RNase H在細胞質和細胞核中都是活躍的,因此基於此機理的ASO藥物可以靶向細胞核內轉錄本,例如未成熟的pre-mRNA和lncRNA,從而間接調控蛋白的合成。在已獲批的ASO藥物中,Fomivirsen、Mipomersen和Inotersen均為RNase H依賴型藥物。
(2)形成空間位阻,阻礙蛋白翻譯
基於空間位阻機制的ASO藥物可以與轉錄本中的特定序列結合,從而阻礙或干擾mRNA、miRNA或Pre-mRNA發揮其正常功能,既可上調基因表達也可下調基因表達。首先,空間位阻型ASO最廣泛的應用是與pre-mRNA結合,改變剪接體的剪接位置,從而選擇性地排除或保留特定的外顯子(外顯子跳躍或外顯子包含),如下圖b所示;其次,ASO也可以通過靶向並結合目標mRNA的AUG起始密碼子,從而中斷翻譯,如下圖c所示;此外,ASO還可靶向上遊開放閲讀框(uORFs):ORFs從起始密碼子開始,結束於終止密碼子,是DNA中具有編碼蛋白質潛能的連續的鹼基序列。由於密碼子讀寫起始位點的不同,mRNA序列可能按六種ORF閲讀和翻譯。一些轉錄本包含uORFs,可調節初級開放閲讀框(pORF)的翻譯活動,而使用ASO藥物靶向uORF會破壞這一調控,激活pORF翻譯,如下圖d所示。在已獲批的ASO藥物中,Eteplirsen、Golodirsen和Nusinersen均為空間位阻機理。
圖9 ASO藥物作用機理多樣

資料來源:《Advances in oligonucleotide drug delivery》
3.1.2
Ionis和Sarepta為ASO藥物領頭企業
ASO藥物經過一定的化學修飾之後,其在體內的穩定性、免疫原性、半衰期等均有所改善,因此其對遞送系統的依賴程度相對較低,這也是ASO藥物早期發展較快的原因之一。儘管如此,ASO藥物行業的進入門檻仍然較高,全球處於實驗室階段之後的項目不足300個,治療領域主要集中於腫瘤、神經與肌肉疾病。從ASO藥物競爭格局來看,行業集中度較高, Ionis、Sarepta兩家公司經過較長時間的研發積累,在ASO化學修飾方面形成了專利和技術護城河,成為該領域的領頭企業。
(1)Ionis:ASO藥物龍頭企業
Ionis Pharmaceuticals成立於1989年,公司搭建了一種高效的ASO研發平台。目前已批准上市的9種ASO藥物中,Ionis佔據了5個。其中,Ionis和Biogen開發的針對脊髓性肌萎縮症(SMA)的Nusinersen是ASO藥物中的明星產品,於2016年獲批,已經在50多個國家上市,儘管價格高昂,但需求不斷增長,2019年銷售額已經突破20億美元,為小核酸藥物領域銷售額最高的產品。同時,Ionis在研管線佈局非常豐富,截至2021年8月,進入臨牀階段的管線有39個,治療領域涵蓋了心腎疾病、代謝性疾病、神經系統疾病、感染性疾病、癌症、眼部疾病、血液疾病等。
Ionis在化學修飾、遞送技術等核心技術方面進行了完備的專利佈局,已經形成完整成熟的技術體系。通過結構設計和化學修飾,其藥物可以實現靜脈注射、皮下注射、口服、髓鞘內注射等多種給藥方式。公司也在持續地優化其化學修飾技術以進一步提高藥物的穩定性、親和力、特異性、對特定組織和細胞的靶向性等。此外,Ionis也有自己的核心遞送技術LICA(Ligand Conjugated Antisense),LICA可將一個Ligand與核酸藥物相連接,使ASO可以通過該Ligand與特定的細胞受體結合,實現靶向遞送。正是得益於其核心技術平台和專利佈局,Ionis可通過技術和產品的對外授權或合作開發獲得非常可觀的授權費用或銷售分成。
圖10 Inios多個管線處於臨牀階段

資料來源:Ionis,國泰君安證券研究
圖11 Ionis管線覆蓋多個疾病領域

資料來源:Ionis,國泰君安證券研究
(2)Sarepta——杜氏肌營養不良症領域的王者
Sarepta成立於1980年,是一家全球性生物技術公司。公司佈局ASO、基因編輯、基因治療等多個技術平台,目前已經有3款ASO藥物獲得FDA批准上市,分別為Eteplirsen、Golodirsen、Gasimersen,均用於治療不同類型基因突變的杜氏肌營養不良症(DMD)。同時,Sarepta基於不同技術平台佈局了近40個在研管線,主要針對肌肉領域的各類罕見病。
Sarepta的核心技術之一為PMO(磷酸二酰胺嗎啉代寡聚體)化學修飾技術平台和外顯子跳躍技術,主要用於空間位阻機制的ASO藥物開發,以增強ASO藥物的親和力和穩定性,公司已獲批上市的ASO藥物均使用PMO進行化學修飾。
公司目前正在開發第二代技術PPMOs(Peptide phosphorodiamidatemorpholino oligomers),即在PMO的基礎之上添加一個具有靶向功能的多肽,用於增加藥物組織的滲透性。PPMO修飾的ASO可以提高藥物在骨骼肌、心肌、平滑肌等組織的遞送效果,擴大其可能治療的疾病範圍。
圖12 Sarepta公司在研管線進度情況

資料來源:Sarepta,國泰君安證券研究
圖13 Sarepta公司在研管線基於多樣化的技術平台

資料來源:Sarepta,國泰君安證券研究
3.2
siRNA藥物:高效持久,潛力巨大
從1998年RNAi現象被科學家發現後,全球範圍內迅速掀起了siRNA藥物研發熱潮。但受限於當時基因測序、遞送技術尚不成熟,藥物的免疫原性和毒副作用等問題無法攻克,siRNA藥物的開發遭遇困境。伴隨着理論研究的深入以及藥物遞送等關鍵技術的突破,siRNA藥物近年來再次受到廣泛關注,成為小核酸藥物領域的研究熱點。2018年8月,FDA批准了全球首個siRNA藥物Patisiran,用於治療遺傳性轉甲狀腺素蛋白澱粉樣變性(hATTR)伴多發性神經病變,預示着siRNA藥物的發展步入了新階段。相較於其他類型的小核酸藥物,siRNA藥物具有更加高效且藥物作用週期更長的優勢,未來潛力巨大。
3.2.1
siRNA的作用機理
siRNA通常為含有20~25個鹼基對的短雙鏈RNA片段。當dsRNA藥物進入細胞內後,核酸內切酶Dicer和TRBP共同作用將其切割成多個具有特定長度和結構的小片段siRNA,隨後其與AGO2等結合,形成siRNA誘導沉默複合體(siRNA-induced silencing complex,siRISC),siRISC中的siRNA經AGO2作用分解成兩條單鏈,正義鏈被釋放出去,反義鏈則留在siRISC中;僅含反義鏈的siRISC被激活,在反義鏈的引導下通過鹼基互補配對原則與靶標mRNA結合,誘導靶標mRNA降解,從而抑制蛋白的表達。
圖14 siRNA藥物作用機理

資料來源:《Advances in oligonucleotide drug delivery》
與ASO相比,siRNA藥物的優勢主要體現在:
(1)理論上siRNA藥物的藥效作用更持久
當一個基因沉默過程完成後,靶標mRNA被釋放,siRISC將與另一個靶標mRNA結合,開始誘導新一輪的基因沉默,這一過程可循環多次。因此,siRNA藥物在細胞內可實現更加持久的基因沉默效果。
(2)siRNA可以做到更高效
雙鏈siRNA進入細胞內形成siRISC後,經AGO2作用解開成兩條單鏈,反義鏈留在siRISC中誘導靶標mRNA沉默,正義鏈被釋放出去。被釋放的正義鏈可能很快被降解,同時也可以作為引物,在RNA依賴的RNA聚合酶的催化下以靶mRNA為模板擴增得到dsRNA,dsRNA又被Dicer降解成siRNA進入RNAi循環,誘導基因沉默,從而使得siRNA藥物的效果級聯放大。
而另一方面,siRNA也存在其自身的侷限性:
(1)不能作用於細胞核內的轉錄本
ASO的作用機理之一是招募RNase H誘導靶標RNA的降解,RNase H在細胞質和細胞核中均活躍存在,因此ASO藥物可以靶向和沉默細胞核內轉錄本。而由於RISC普遍存在於細胞質中,因此siRNA無法針對細胞核內的轉錄本發揮沉默效果。
(2)siRNA對遞送系統要求更高
除了同樣面臨血液中的穩定性和免疫原性問題外,由於siRNA為雙鏈結構,疏水鹼基對未暴露且親水性更強,故較難穿過細胞膜而被攝取。因此,與ASO藥物相比,siRNA對遞送系統有更高的要求和更強的依賴。
(3)潛在的脱靶效應
ASO藥物對應的RNAase H只有在完全互補配對的情況下才可能發揮作用,序列特異性很高。而siRNA對應的AGO2酶只需要8個核苷酸的種子序列匹配即可誘導降解,易發生miRNA樣脱靶效應。
3.2.2
Alnylam:siRNA藥物領域的領先者
Alnylam成立於2002年,一直專注於siRNA藥物的研發,是該領域的領先企業。公司所研發的針對FAP的藥物patisiran是全球第一款獲批的siRNA藥物,目前全球已經獲批的4款siRNA藥物均來自Alnylam。與此同時,公司擁有豐富的研發管線,其中有4個管線已進入後期臨牀階段(II~IV期),6個管線進入早期臨牀階段(IND~II期),治療領域覆蓋了遺傳病、代謝疾病、感染性疾病、中樞神經系統疾病以及眼科疾病等。
Alnylam在小核酸的化學修飾、核酸序列設計以及藥物遞送技術等方面都有深厚的積累,先後開發了多種核酸修飾技術、多代siRNA序列模板設計技術以及兩項藥物遞送系統:脂質納米粒子遞送平台(LNP)和GalNAc遞送平台。同時,公司也在開發新一代的修飾和遞送技術,以增強藥物的特異性和治療窗口,擴大藥物的治療領域。
得益於其先進的技術平台,Alnylam在小核酸藥物的研發上具有超高的效率和極高的成功率。Alnylam預計,從目前到2025 年,公司每年將有2~4個研發項目可以遞交IND申請。此外,Alnylam的研發項目從I期臨牀進展到III期臨牀結束的成功率達到54.6%,遠遠高於創新藥開發的行業平均值。
圖15 Alnylam公司的在研管線
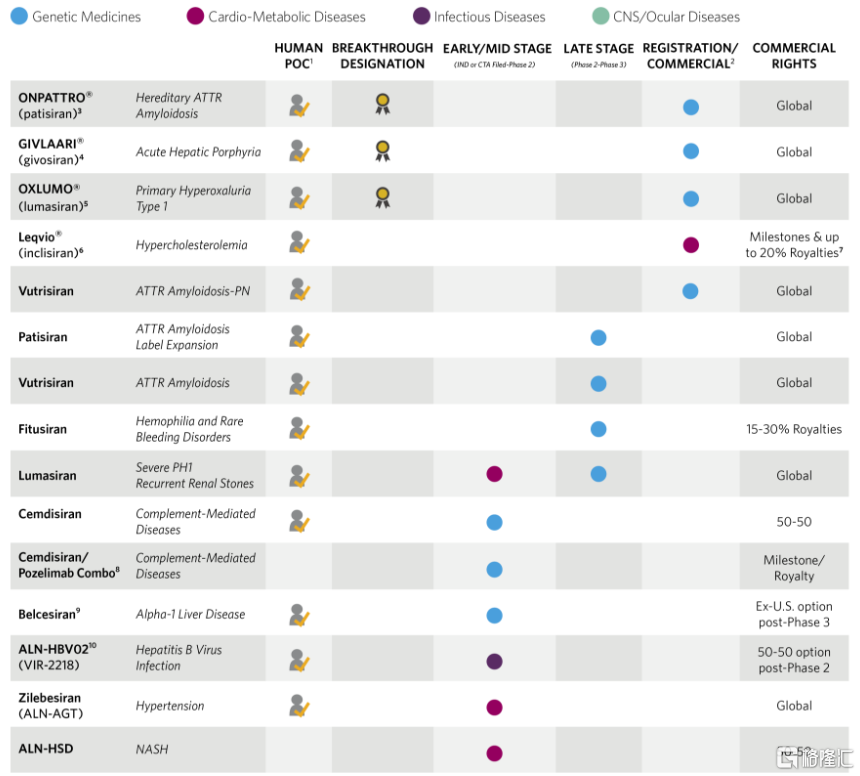
資料來源:Alnylam
3.3
miRNA藥物:調節多種mRNA翻譯
miRNA是一類內生的、長度約為15~25個核苷酸的小單鏈RNA,1993年首次在線蟲中被發現。miRNA本身不編碼蛋白質,但其可以與靶mRNA互補結合,調節靶mRNA的翻譯過程,目前,在人體內已經發現約2000種miRNA。由於miRNA識別靶mRNA並不需要完美的鹼基配對,一個miRNA可以同時調節多個轉錄本的翻譯,而幾個miRNA也可以調節同一個轉錄本,據推測,miRNA調節着人類超過三分之一的基因表達。研究發現,許多miRNA在人類疾病的發病機制中發揮重要作用,如腫瘤、肝炎、心血管疾病等,因此miRNA也成為開發針對這些疾病藥物的一個重要思路。miRNA複雜而又精細的調節機制導致miRNA藥物的研發難度較高,目前尚未有miRNA藥物獲批上市,但已有較多管線進入臨牀試驗階段。
3.3.1
miRNA藥物的作用機理
在細胞中,成熟的miRNA分子可與AGO蛋白家族形成miRNA誘導沉默複合體(miRISC),通過鹼基互補配對結合並降解靶mRNA,誘導基因沉默。根據藥物作用機理不同,miRNA藥物可分為兩類:miRNA拮抗劑(miRNA antagonist)和miRNA類似物(miRNA mimics)。
(1)miRNA 拮抗劑
miRNA拮抗劑有兩種設計思路:一種思路為以體內miRNA為靶標,與miRISC中的成熟miRNA結合,阻斷下游基因沉默的發生;另一種思路以mRNA為靶標,通過與mRNA結合來佔據其與miRISC的結合位點,避免其被降解,進而阻斷下游基因沉默。
(2)miRNA類似物
miRNA類似物與人體內miRNA功能類似,可將其導入病理細胞中補充發揮缺失的miRNA的正常生理功能。例如,一些抑制腫瘤相關基因表達的miRNA可能在癌細胞中消失,那麼通過相應的miRNA類似物替代治療策略則可發揮抑癌效果。
與siRNA不同,miRNA是內源性成分,並通過內源性RNAi機制實現基因沉默。因此,理論上人體細胞內引入miRNA藥物可具有更好的耐受性,這也是miRNA藥物的一個潛在優勢。
圖16 miRNA藥物的作用機理
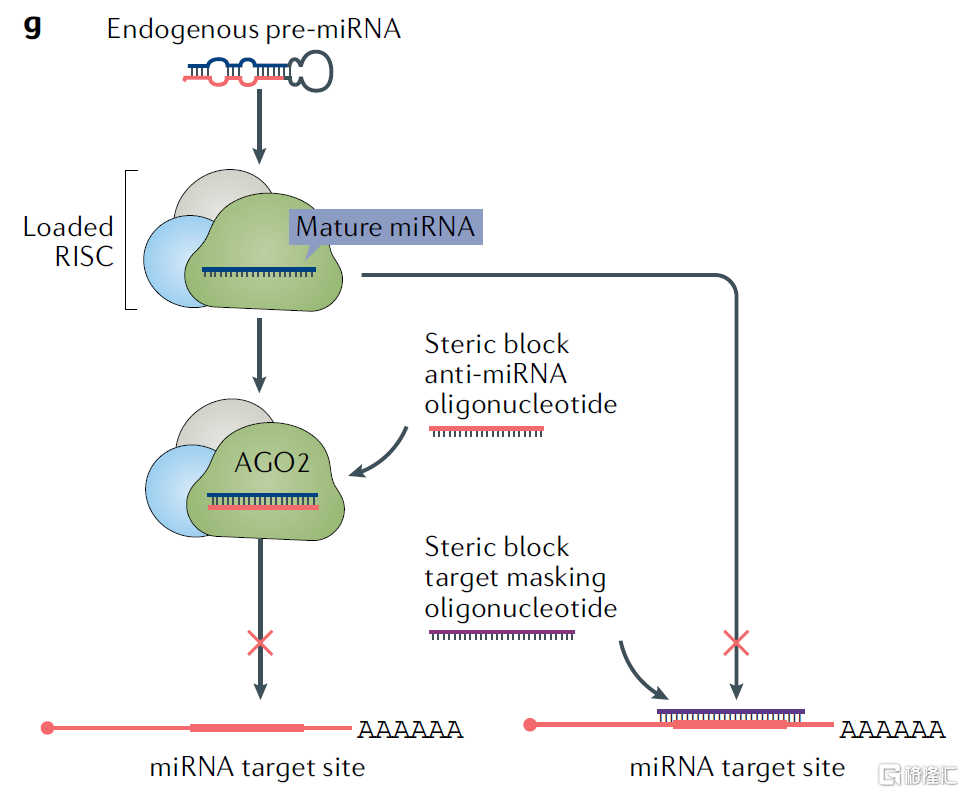
資料來源:《Advances in oligonucleotide drug delivery》
3.3.2
Regulus:專注於miRNA藥物開發
Regulus Therapeutics創立於2007年,致力於發現和開發以miRNA為靶標的創新藥物。公司建立了豐富均衡的miRNA 藥物研發管線,保持着在miRNA領域的領先地位。目前,Regulus針對遺傳性腎炎的管線已進入臨牀II期階段,針對常染色體顯性多囊的管線已進入臨牀I期階段。此外,公司還正在進行鍼對感染、肝臟疾病等領域的miRNA藥物開發。
圖17 Regulus公司研發管線

資料來源:Regulus
3.4
saRNA藥物:通過上調基因表達發揮作用
2006年,加州大學聖地亞哥分校的華裔科學家李龍承博士在全球首次揭示了人類細胞中存在小dsRNA誘導轉錄激活的現象,並將該現象命名為“RNA activation”,即RNA激活。2014年,英國MiNA Therapeutics公司獲得了李龍承實驗室有關RNA激活技術的開發權益。短短兩年後,該公司宣佈全球首個saRNA藥物進入臨牀試驗,用於肝癌治療。saRNA作為一種新的疾病治療思路,在生命健康領域具有廣闊的應用前景。
3.4.1
saRNA藥物的作用機理
saRNA是由約21對核苷酸構成的雙鏈RNA,其結構與siRNA較為類似,但功能卻不同。saRNA在細胞質中與AGO2蛋白結合後會移除正義鏈,形成saRNA-AGO2複合物,然後進入細胞核招募RHA和CTR9形成RNA介導的轉錄激活複合物(RITA,RNA induced transcriptional activation),隨後複合物中反義鏈會和對應基因啟動子/增強子等區域的靶序列結合,通過RNA聚合酶II的作用增強相應基因的表達,進而達到治療疾病的目的。
這種通過“做加法”來實現疾病治療的全新思路被認為在腫瘤、遺傳代謝病等重大疾病領域具有巨大的應用前景。例如,saRNA可通過作用於抑癌基因啟動子的特定序列來上調或激活抑癌基因的表達,達到抑制癌細胞的增殖、侵襲和遷移的效果。
圖18 saRNA藥物的作用機理
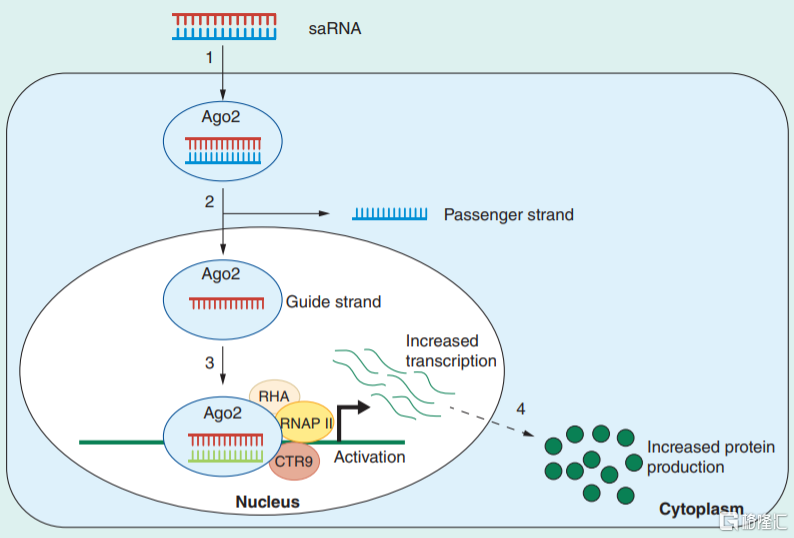
資料來源:《Developing small activating RNA as a therapeutic: current challenges and promises》
但同時,saRNA藥物的獨特作用機制也導致其開發難度要高於siRNA等其他小核酸藥物。一方面,saRNA的作用靶標為基因的啟動子區域,這就決定了saRNA藥物必須進入細胞核才能發揮作用,其對遞送技術的要求更高;另一方面,由於DNA纏繞在組蛋白上,以核小體的形式存在,因此saRNA藥物的靶點並非全完暴露,且DNA又是雙鏈的,這都將影響saRNA與靶點的順利結合,saRNA藥物的發展也因此相對緩慢。
3.4.2
MiNA Therapeutics:全球首家開發saRNA療法的企業
MiNA Therapeutics成立於2008年,是全球第一家開發saRNA藥物的公司。在2014年取得saRNA基礎專利後,公司在2016年便開始了全球第一款saRNA藥物的臨牀研究。目前,MiNA Therapeutics共有5個在研產品,其中針對腫瘤的管線MTL-CEBPA的兩種聯合療法已處於臨牀I/II期階段,分別為與索拉非尼聯用治療肝細胞癌(HCC),以及與帕博利珠單抗聯用治療晚期實體瘤。2020年5月,MiNA公佈了MTL-CEBPA聯合索拉非尼治療HCC的Ib期劑量遞增和隊列擴展研究的頂線數據,試驗達到了安全性和耐受性的主要終點。此外,公司有另外三個管線處於藥物發現階段。
圖19 MiNA Therapeutics公司研發管線

資料來源:MiNA Therapeutics
MiNA獨特的saRNA技術平台也吸引了眾多醫藥巨頭與之合作。2017年,勃林格殷格翰與MiNA達成合作,二者將共同開發非酒精性脂肪性肝炎和其它纖維化疾病的saRNA療法;2020年,阿斯利康也宣佈將與MiNA在代謝性疾病領域展開研究合作;2021年,法國知名藥企Servier宣佈與MiNA建立研究夥伴關係,就神經系統疾病共同合作開發saRNA療法。
3.5
Aptamer:通過三維結構結合靶標分子
Aptamer技術最早於1990年由L. Gold和J. Szostak提出。Gold研究組運用體外篩選技術獲得了能與T4 DNA聚合酶特異性結合的RNA分子,並將其所運用的寡核苷酸配體篩選方法定義為配體指數富集的系統進化技術(the systematic evolution of ligands by exponential enrichment process),簡稱SELEX。此後,雖然Aptame在實驗室研究中不斷突破,但其商業化的臨牀應用一直未能廣泛開展起來。迄今為止,全球僅有Pegaptanib一款Aptamer藥物獲批,用於治療新生血管性年齡相關性黃斑變性(wAMD),其商業化也遇到了較大阻礙。
3.5.1
Aptamer藥物的作用機理
Aptamer是摺疊成獨特三維結構的短單鏈寡核苷酸,其可以是DNA也可以是RNA,通常是20~70個核苷酸,DNA aptamer穩定性更高,RNA aptamer具有更多的動態結構,更加靈活。與ASO、siRNA、miRNA和saRNA等藥物的作用原理不同,Aptamer藉助靜電、氫鍵、範德華力、疏水作用等非共價作用力形成能夠與靶標分子相作用的結合口袋和裂隙,並通過這些特殊的三維立體結構,高親和力和特異性地識別並結合靶分子,發揮類似於抗體或化學抑制劑的功能,其特異性和結合親和力可達到抗體水平。Aptamer的靶標選擇範圍很廣,包括蛋白質、小分子、金屬離子、病毒、細菌和全細胞等。
圖20 Aptamer識別靶標分子

資料來源:南京大學官網
Aptamer通常用SELEX技術進行篩選:先構建長度在20~100個核苷酸的隨機寡核苷酸序列文庫,將其與靶標孵育一定時間後,移除未結合的分子,而結合的寡核苷酸序列在洗脱後經PCR擴增形成新的文庫,該過程重複8~20次即可篩選出高特異性和高親和力的Aptamer。
圖21 SELEX篩選技術示意圖

資料來源:《Aptamers as Therapeutics》
由於與抗體藥物發揮類似的效果,Aptamer藥物經常被拿來與抗體藥物進行比較。與單抗相比,Aptamer具有諸多優點。 一方面,Aptamer的篩選和確認均在體外進行,不依賴於細胞、動物甚至體內條件,且其大規模生產不需要組織培養和血清純化等步驟,一旦確定序列後,即可以通過寡核苷酸合成方法實現精準重複和大規模製備,重複性好,穩定性高,成本低,週期短;另一方面,Aptamer的靶分子範圍極廣,除了蛋白之外,還包括糖類以及其他小分子,通過Cell-SELEX技術可以篩選出病原微生物、腫瘤細胞等多種細胞表面的未知分子標誌物作為靶點。Aptamer藥物最大的侷限性在於其體內穩定性,Aptamer作為小分子核酸在體內很容易被核酸酶破壞清除,半衰期短,因此需要通過修飾來提升其穩定性。短期來看,Aptamer藥物可能還無法與目前種類眾多、治療領域不斷豐富的抗體藥物抗衡,其商業化進程也面臨來自抗體藥物的巨大競爭壓力。但同時,人們也開始關注Aptamer在藥物遞送和疾病診斷領域的潛在應用價值。Aptamer可以通過linker與蛋白、小分子藥物、核酸藥物、毒素和光敏物質連接,在藥物靶向遞送和分子成像等領域具有較大的應用潛力。此外,Aptamer擁有類似抗體特異性結合力,可開發出多樣化的免疫診斷試劑盒。目前,已有識別HER3、OX40、CD137、VEGF的RNA aptamer用於癌症檢測,其在IVD領域應用前景廣闊。
圖22 Aptamer作為藥物載體
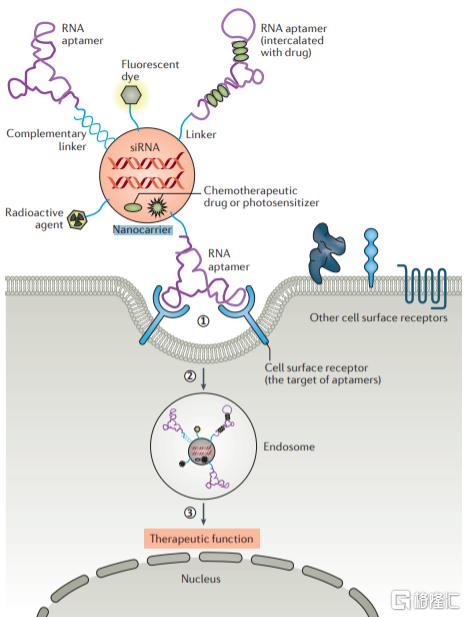
資料來源:《Aptamers as Therapeutics》
3.5.2
NeXstar:迄今唯一成功開發Aptamer藥物的企業
NeXstar是最早研究Aptamer藥物的企業之一,成功開發了目前全球僅有的一款Aptamer藥物Pegaptanib(其臨牀試驗由Eyetech和輝瑞合作進行)。1999年,NeXstar被吉利德收購。Pegaptanib靶向VEGF165,於2004年獲FDA批准上市,用於新生血管性年齡相關性黃斑變性的治療,2005年銷售額達到1.85億美元。戲劇性的是,隨着針對同適應症的抗體類藥物Lucentis、Avastin、Eylea的上市和推廣,Pegaptanib面臨巨大的競爭壓力,迅速失去市場,2006年的銷售額降至500萬美元,2008年銷售額僅為120萬美元。
除了NeXstar之外,德國的NOXXON Pharma公司在Aptamer藥物領域亦有廣泛佈局。與行業內其他致力於研究常規Aptamer藥物的企業不同,NOXXON公司專注於一種較為特殊的Aptamer藥物——Spiegelmers,即鏡像寡核酸鏈或L型寡核酸鏈。L型核酸是與天然D型核酸(DNA或RNA)呈鏡像對稱的核酸分子,由於L型核酸難以被天然存在的各類核酸酶降解,這意味着它可以在不經過任何修飾的情況下擁有較高的穩定性,具有較長的半衰期。目前,NOXXON針對II型糖尿病、系統性紅斑狼瘡以及各類實體瘤的Aptamer研發管線已進入臨牀研究階段。
圖23 NOXXON公司Aptamer藥物研發管線

資料來源:NOXXON
3.6
mRNA藥物:疫苗領域的明日之星
1990年,Wolff等首次報道肌內注射mRNA到小鼠骨骼肌實現了編碼蛋白的表達。此後,基於mRNA的治療方法在疫苗、腫瘤免疫治療、蛋白替換和細胞基因工程等領域被廣泛研究。在本次新冠疫情中,mRNA疫苗彰顯了巨大優勢和平台化能力,打破了諸多質疑,使mRNA藥物受到極大的關注。
3.6.1
mRNA藥物的作用機理
mRNA療法主要應用在兩個方面:(1)將表達抗原蛋白的mRNA導入體內,即製成傳染病疫苗,這是mRNA目前最主要的應用領域;(2)通過外源導入mRNA來糾正基因表達缺陷或異常,即蛋白替代療法。
針對傳染病的mRNA疫苗是指將編碼病毒抗原蛋白的mRNA導入人體,在細胞內直接進行翻譯,形成相應的抗原蛋白,從而誘導機體產生特異性免疫應答,達到預防免疫的作用。相比於傳統疫苗,mRNA疫苗最大的優勢在於無需經過毒株篩選、分離、培養、傳代等過程,直接利用公佈的病毒核酸序列即可開始疫苗研製,且其生產工藝簡單,無需細胞培養或動物源基質,合成速度快、成本低,非常適合應對大規模突發新型傳染病。在此次新冠疫情期間,Moderna和BioNTech的新冠疫苗在III期臨牀試驗中的保護率分別高達94.1%和95%,其開發速度快、保護率和安全性高的特點迅速吸引了全球醫藥產業界的關注。此外,針對病毒變異,mRNA疫苗只需對核酸序列進行修改,其靈活性要遠高於滅活疫苗和重組蛋白疫苗。mRNA疫苗為平台型技術,一旦突破了遞送方面的挑戰,即可基於同一遞送系統開發不同系列的疫苗。目前,針對流感、寨卡、狂犬病等其他病毒的mRNA疫苗也在快速研發之中。
治療性的腫瘤mRNA疫苗可分為兩類:基於樹突狀細胞(DC)給藥的mRNA疫苗和直接注射進體內的mRNA疫苗。基於DC細胞的mRNA疫苗類似於體外的“基因療法”,在體外將腫瘤抗原相關mRNA轉染至DC細胞後,在細胞質中翻譯形成抗原,與DC細胞作用,激活DC細胞;然後將已激活的DC細胞注入人體,激發體內免疫系統應答,以達到殺死腫瘤細胞的目的。直接注射的mRNA疫苗是通過一定的給藥途徑或遞送體系,將編碼腫瘤相關抗原的mRNA導入患者體內,從而刺激機體產生抗體,抑制腫瘤細胞生長。目前,mRNA腫瘤疫苗已被廣泛研究,應用於包括前列腺癌、急性骨髓白血病、轉移黑色素瘤、肺癌等多種類型的腫瘤,多個管線已進入臨牀試驗階段。
圖24 mRNA新冠疫苗原理

資料來源:《Meet the mRNA vaccine rookies aiming to take down COVID-19》
蛋白替代療法也是mRNA的一個潛在應用領域。理論上,mRNA可編碼體內任何一種蛋白,其作為蛋白替代療法正在探索中。例如,通過導入編碼抗體的mRNA進行免疫治療,目前已有多款相關產品進入臨牀前或臨牀階段。相比傳統的抗體藥物,mRNA藥物具有其獨特優勢。首先,mRNA在體內的翻譯可持續數天,有望降低給藥頻率;其次,mRNA 可以進入到細胞內編碼針對細胞內靶點的抗體,而大分子抗體很難進入細胞內;最後,通過序列設計,mRNA可以編碼多種抗體,理論上通過一次給藥即可達到抗體聯用的效果。但同時,基於mRNA的蛋白替代療法也存在一定的侷限性,例如mRNA本身的不穩定性、免疫原性等;此外,蛋白替代療法需要在翻譯後對蛋白進行修飾,不同細胞的修飾過程和結果可能不同,因此需要將mRNA精準遞送至正確的細胞中才能發揮相應的效果,這對遞送系統的要求很高。
據中國食品藥品網資訊,目前全球累計有超過150種mRNA藥物及疫苗的研發管線,其中47%應用於傳染病領域,30%應用於腫瘤治療領域,17%應用於蛋白質替代以及基因治療。
3.6.2
Moderna、BioNTech:mRNA雙雄
(1)Moderna:專注mRNA療法,研發管線豐富
Moderna成立於2010年,2018年在納斯達克上市。公司擁有自主完整的mRNA技術平台,包括mRNA修飾改造、LNP遞送系統和生產平台。同時,Moderna也是研發管線最為豐富的mRNA製藥企業之一,目前共有23條mRNA藥物在研管線,包括9個預防性疫苗、4個系統分泌和細胞表面療法、2個癌症疫苗、3個瘤內注射產品、1個局部再生療法及4個系統細胞內療法。目前,Moderna共有15個管線進入臨牀開發階段,其中針對鉅細胞病毒(CMV)感染的mRNA-1647、腫瘤疫苗mRNA-4157和針對心衰及心臟病的AZD8601三個管線進展最快,均已進入II期臨牀階段。此外,公司新冠mRNA疫苗已獲批上市。
圖25 Moderna在研管線

資料來源:Moderna
(2)BioNTech:技術平台多樣,腫瘤管線突出
BioNTech成立於2008年,2019年在納斯達克上市,公司致力於開發更精確、更個性化的免疫療法。除mRNA技術平台外,BioNTech還擁有抗體技術平台、小分子技術平台以及細胞療法平台等。在mRNA技術平台方面,其FixVac平台主要針對癌症免疫療法,RiboMabs平台主要針對重組抗體替代療法,RiboCytokines是針對細胞因子替代療法。此外,公司還通過和Genevant合作獲得了LNP遞送技術。
BioNTech目前已有1個研發管線進入臨牀II期階段、11個管線進入臨牀I期研究,其mRNA研發管線以腫瘤相關產品為主,覆蓋了頭頸鱗癌、黑色素瘤、前列腺癌等多個適應症。其中,BioNTech與Genentech聯合開發的個性化mRNA腫瘤疫苗iNeST(BNT122)進展最快,黑色素瘤適應症已進入II期臨牀階段,多發性骨髓瘤適應症已進入I期臨牀階段。此外,公司新冠mRNA疫苗已獲批上市。
圖26 BioNTech研發管線

資料來源:BioNTech
四、化學修飾和遞送系統是小核酸藥物開發的關鍵
外源的核酸藥物從進入體內到發揮藥效作用需要克服多個難題:(1)穩定性問題,易被快速排出至體外或被體內的核酸酶降解;(2)免疫原性問題,會激活人體免疫系統的反應;(3)組織靶向問題,會在許多非藥物活性部位的組織中積累,併產生毒性;(4)細胞攝取問題,核酸藥物分子結構較大、親水性高,且帶有負電荷,穿透細胞膜的難度較高;(5)內體逃逸問題(endosome escape),核酸分子進入細胞後需要從內體中逃逸進入細胞質才能發揮作用。化學修飾和遞送系統是解決上述問題的關鍵策略,這兩項技術的突破對小核酸藥物的發展起到了至關重要的作用,也將在很大程度上影響小核酸藥物未來的發展前景。
圖27 小核酸藥物在體內經歷的路徑

資料來源:《Nanoparticle-Mediated Systemic Delivery of siRNA for Treatment of Cancers and Viral Infections》
4.1
化學修飾:增強核酸藥物穩定性的基礎
對於小核酸藥物進行化學修飾可以達到兩個主要效果:首先,化學修飾可減弱生物體先天免疫機制對RNA藥物的免疫反應,降低藥物的免疫原性;其次,可增強RNA藥物抵抗內源性內切酶和外切酶降解的能力,提高RNA的穩定性,延長藥物半衰期。
根據不同的修飾位點,目前常用的核苷酸化學修飾技術包括磷酸骨架修飾、核糖修飾、核糖五元環改造、鹼基修飾、核苷酸鏈末端改造等。
圖28 核苷酸的化學修飾策略

資料來源:《Advances in oligonucleotide drug delivery》
(1)磷酸骨架修飾
針對磷酸骨架最常用的化學修飾是硫代磷酸(PS),即將核苷酸中磷酸骨架的一個非橋氧用硫進行替代。PS修飾基本不影響核酸藥物的活性,但可以抵抗核酸酶的降解,而且該改造可增強其與血漿蛋白的結合能力,降低腎臟清除速率,提高半衰期,改善藥物的藥代動力學。PS是第一代ASO藥物中常見的化學修飾,現在依然被廣泛應用於小核酸藥物的開發。
PS修飾一個主要缺點是每個PS修飾都會產生兩種具有不同空間取向的立體異構體,因此PS修飾的寡核苷酸實際上是外消旋體的混合物,而這兩種不同取向的分子具有不同的藥代動力學和藥效學特徵。通常來説,分子的異質性和不均一性不利於其臨牀開發,因此發展具有立體選擇性的PS修飾技術成為未來的一個突破方向。例如,Wave Life Sciences公司已經開發了一種可擴展的方法來合成在每個PS鏈上都具有固定立體化學結構的寡核苷酸。PS修飾的另一個缺陷是會降低寡核苷酸對其靶標結合的親和力,這一限制可以通過合併其他類型的修飾來彌補。
(2)核糖修飾
對核糖結構的修飾屬於第二代化學修飾技術。寡核苷酸在核糖2’端的羥基(-OH)可以被甲氧基乙基(MOE)、甲氧基(OMe)、氟(F)等取代,用於降低免疫原性,增加對核酸酶的耐受力,改善血漿的穩定性,進而延長藥物半衰期。例如,2’-MOE修飾可以將小核酸藥物的清除半衰期延長至2-4周,並提高其與靶向mRNA的結合能力以及效力,降低細胞毒性;2’-OMe修飾可提高藥物穩定性,並一定程度上提高藥效和降低免疫原性;2’-F修飾可提高藥物與靶向mRNA的結合能力但不能提高穩定性,更適用於RISC機制的siRNA藥物。
值得注意的是,核糖2’端修飾與RNase H活性不兼容,因此其不常用於RNase H依賴型的ASO藥物,而更多用於空間位阻型的ASO或Gapmer ASO的側翼序列。此外,由於AGO2對結構的選擇性限制了可以使用的化學修飾類型,2’-MOE修飾通常也不被納入siRNA藥物的設計中。
(3)核糖五元環改造
對核糖的五元環進行改造被歸為第三代化學修飾,包括LNA(鎖核酸,locked nucleic acid)、PNA(肽核酸,peptide nucleic acid)、PMO(嗎啉代寡核苷酸,phosphoroamidate morpholino oligomer)等。LNA是經典的核苷酸橋接修飾技術,其通過核苷酸第2和第4個碳原子之間的橋連而將其構象固定,增強了藥物對核酸酶的抗性以及對靶mRNA的親和力。但LNA導致的構象改變使核苷酸與RNase H不相容,因而更多地被用於Gapmer ASO的側翼區域或空間位阻型ASO。此外,LNA修飾的RNA藥物在部分臨牀中觀察到了肝毒性與腎毒性,其後續發展需繼續關注。PNA和PMO改造可以增強核酸藥物對核酸酶的抵抗、提高親和力和特異性等。但PNA和PMO為電中性,與血漿蛋白結合能力較弱,因此容易通過腎臟排泄迅速清除,半衰期較短。對於PMO修飾,還需注意的是其主鏈包含手性中心,因此PMO修飾的核酸藥物也是外消旋體混合物。
(4)鹼基修飾
小核酸藥物對鹼基改造的耐受性相對較差,已上市的產品中鮮有采用這一修飾手段。但企業對於鹼基修飾也在不斷嘗試中,例如,5’-Methylcytidine(甲基胞苷)與5’-Methyluridine(甲基尿苷)修飾可以提高藥物與靶mRNA的結合能力,降低免疫原性;嘧啶的甲基化可提高寡核苷酸熔解温度,提高藥物穩定性和與靶mRNA的結合能力,通常被應用於ASO藥物中,而Ionis公司正在開發的ASO藥物均有所使用。
(5)末端改造
核苷酸的末端改造主要是為了避免核苷酸鏈被核酸外切酶降解,例如,在3’端添加反式胸苷(inverted thymidine),或者在末端添加軟脂酸或偶聯芳香化合物。
特定的化學修飾對提高藥物安全性和有效性至關重要,迄今為止,FDA批准的RNA靶向藥物幾乎均進行了化學修飾。
圖29 FDA批准的小核酸藥物的化學修飾類型(截至2020.10)

資料來源:《Advances in oligonucleotide drug delivery》
4.2
遞送系統:提升靶向性和生物利用度的關鍵
化學修飾能夠在一定程度上解決小核酸藥物穩定性和免疫原性的問題,延長藥物的半衰期。但小核酸藥物要想發揮藥效作用,還需在病灶部位富集、通過跨膜轉運進入細胞內、實現內體逃逸進入細胞質,這些過程都是制約小核酸藥物發展的主要瓶頸,而遞送系統則是突破上述瓶頸的重要途徑。對於核酸藥物,遞送系統的功能主要有兩個:(1)藥物靶向,即將藥物精準遞送至病灶組織;(2)藥物控釋,即確保藥物進入正確的空間並在合適的時間釋放,發揮藥理作用。
遞送系統可分為病毒載體和非病毒載體兩個大類,病毒載體在基因治療中應用較多,但由於其免疫原性、安全性以及載藥量的限制,在小核酸藥物中應用較少。根據不同的材料,目前針對小核酸藥物開發的非病毒載體可分為脂質類、聚合物類和特定靶向配體類。
4.2.1
脂質類遞送系統
脂質類載體是目前研究最多的遞送系統,早在1995年,第一個基於脂質的藥物製劑Doxil(一種抗腫瘤抗生素)即獲批上市。在小核酸藥物領域,2018年全球第一個被批准上市的siRNA藥物Patisiran以及疫情期間獲批的mRNA疫苗都是採用脂質類的遞送系統。根據性質和結構的不同,脂質類遞送系統可主要分為脂質體(liposome)和脂質納米顆粒(LNP,lipid nanoparticle)。
(1)脂質體
脂質體是由磷脂組成單層或多層的囊泡狀結構,在小分子藥物的遞送中被廣泛使用。脂質體的磷脂雙分子層內部為疏水結構,中間通常為水溶液內核,因此脂質體既可以遞送親水性藥物,又可遞送疏水性藥物。脂質體在體內的穩定性和靶向性等特徵可以通過顆粒尺寸、表面電荷、脂質分子成分以及表面修飾(配體或聚合物)進行優化。例如,PEG(聚乙二醇)修飾可提高其在體內的循環時間。目前,基於脂質體遞送系統的小核酸藥物還處於研發階段。
圖30 典型的脂質體藥物遞送系統的設計

資料來源:《Advances and Challenges of Liposome Assisted Drug Delivery》
(2)脂質納米顆粒
脂質納米顆粒(Lipid Nanoparticle,LNP)已在核酸藥物中成功應用,也是目前小核酸藥物領域研究最多的遞送系統之一。與脂質體不同,LNP的結構更為複雜,其內部通常為核酸藥物和脂質分子形成的複合物膠束。LNP的成分通常包含中性磷脂、膽固醇、陽離子脂質、可離子化脂質、聚乙二醇脂質等分子。中性脂質是形成膜結構的主要成分;膽固醇可調節磷脂雙分子層膜的流動性,使膜通透性降低,減少藥物滲漏,同時可維持膜的柔韌性,增強LNP抗擊外部條件變化的能力,並對磷脂的氧化有一定保護作用;陽離子脂質一方面能結合帶負電的小核酸分子,提高其包載率;另一方面可與帶負電的細胞膜作用,促進靶細胞對LNP的攝取。但若陽離子脂質的比例過高,則會激活人體的免疫反應,並在血漿中被快速清除。可離子化的脂質在體液環境中生理pH條件下為電中性,可以避免被清除和過度激活人體免疫反應;當其到達病灶部位,如腫瘤微環境中時,該條件下pH降低、質子化程度升高,使LNP帶正電,提升細胞內吞效率;進入細胞內後,進一步質子化,通過質子海綿效應促進內體逃逸。
LNP可進一步被PEG、靶向基團或其分子修飾和功能化。例如,在LNP中摻入PEG-lipid可以延長其在血液中的循環時間,但PEG保護同樣會阻礙LNP和細胞膜的相互作用,降低內體效率。因此,在進行PEG修飾時,PEG分子長度和修飾密度的選擇是關鍵。此外,LNP表面還可與特定多肽、Aptamer、抗體等功能性分子進行偶聯,賦予其主動靶向功能,促進其在靶組織區域的富集。需要注意的是,對LNP進行修飾會增加其複雜性,這種複雜性可能會帶來不可預測的毒性或激發免疫反應,增加其開發難度。
圖31 LNP小核酸藥物遞送系統

資料來源:《Advances in Lipid Nanoparticles for siRNA Delivery》
4.2.2
聚合物類遞送系統
目前,已有多個基於聚合物遞送系統的化學小分子藥物獲得FDA批准。對於小核酸藥物,具有陽離子骨架的聚合物可通過靜電相互作用包裹核酸分子形成複合物或膠束顆粒,提升小核酸藥物在血液中的穩定性、組織富集效果和細胞內吞效率。聚合物遞送系統一般可分為兩大類:天然聚合物和化學合成聚合物。天然聚合物的優勢在於其生物相容性較高,如殼聚糖(chitosan);化學合成聚合物的優勢在於其可調節性更高,可通過特定的化學反應調控聚合物分子量、拓撲結構、電荷密度、親疏水性、刺激響應性等,如聚乙烯亞胺(polyethyleneimine)、樹枝狀分子(dendrimer)、聚環糊精、聚氨基酸等。同樣地,對於聚合物類遞送系統,也可在其外圍修飾特定的功能性結構,如PEG、靶向基團等,以提高其穩定性和靶向效果。目前,基於聚合物的小核酸遞送系統多處於研發階段。
圖32 典型的基於聚陽離子的核酸遞送系統
資料來源:《Camouflaging bacteria by wrapping with cell membranes》
4.2.3
配體類遞送系統
小核酸藥物也可以通過共價結合到特定的配體上,如GalNAc(N-乙酰半乳糖胺),Aptamer、多肽、抗體等,利用配體的性質將藥物遞送至特定組織和細胞,同時通過連接子(linker)的設計,可實現核酸藥物進入細胞後的可控釋放。
GalNAc是現階段最常用也是最成功的配體類遞送系統,目前已有3款基於GalNAc技術的小核酸藥物獲得FDA或EMA的批准。在臨牀試驗階段的小核酸藥物中,約有三分之一管線採用了多價GalNAc遞送系統。GalNAc可以與ASGPR(去唾液酸糖蛋白受體)特異性結合,ASGPR是一種內吞性受體,在肝實質細胞表面高度特異性地表達(~500,000/細胞),其與網格蛋白介導的內吞作用可以有效地將藥物載體從細胞表面轉運至細胞質,同時具有較高的回收循環速率(~15min)。因此,攜帶小核酸的GalNAc與ASGPR結合後,可將核酸藥物順利帶入肝實質細胞內,提高藥物靶向性和生物利用度。GalNAc生物相容性高、易生產、穩定性好,且其經皮下給藥後循環時間長,藥效和持續時間優於靜脈給藥,未來有望成為靶向肝臟疾病的小核酸藥物使用的主要載體類型。目前全球小核酸製藥企業中,Alnylam、Ionis、Arrowhead、Dicerna等均開發了各自的GalNAc遞送技術平台。
圖33 GalNAc在siRNA藥物遞送中的應用

資料來源:Alnylam
除了GalNAc外,其他的配體類遞送系統也在臨牀開發中,包括抗體、適配體、多肽、內源性外泌體、DNA納米結構等。
圖34 其他配體類核酸遞送系統

資料來源:《Advances in oligonucleotide drug delivery》
五、小核酸藥物開發仍面臨諸多挑戰
5.1
遞送系統仍是制約行業發展的主要瓶頸
(1)內體逃逸效率不高
絕大多數小核酸藥物需要進入到細胞質中才能發揮作用,內體逃逸則是遞送過程中的關鍵一步。目前的遞送技術在提升核酸藥物的穩定性和組織富集度方面取得了重大進展,但在內體逃逸方面卻無明顯突破。由於內體環境中pH較低,目前多數遞送技術會引入pH敏感成分,如可離子化脂質,利用“質子海綿效應”或“膠體滲透壓效應”導致膜溶脹,進而釋放藥物。然而,目前來看,這一機制的效率普遍不高,大部分載體在內吞後僅有0.1-2%的小核酸釋放效率。通過對逃逸機制的進一步研究來優化遞送系統以提高逃逸效率,對擴大小核酸藥物的治療窗口至關重要。
(2)靶向性較為單一
靶向性的單一導致目前小核酸藥物所針對的適應症十分有限。儘管基於LNP和GalNAc的遞送系統在肝臟靶向性方面展現出良好的有效性,局部給藥途徑也解決了部分組織靶向問題,但小核酸藥物若想進一步擴大治療領域,針對肝以外其他器官、組織的靶向遞送技術仍需要進一步的研究開發。
(3)潛在免疫原性問題
小核酸藥物不僅涉及核酸分子本身的免疫原性問題,還涉及到遞送系統的免疫原性問題。目前對於核酸分子及其化學修飾的免疫原性控制已有深入瞭解,但LNP遞送系統中複雜的成分以及所使用的各類配體分子均可能引入由免疫原性導致的安全性問題,平衡遞送系統的有效性和安全性也是小核酸藥物面臨的一個挑戰。
(4)藥物價格昂貴
小核酸可實現自動化的化學合成和提純,其藥物分子本身的生產成本要遠低於抗體類藥物。但由於化學修飾和遞送系統的研發以及工藝成本高昂,導致目前小核酸藥物非常昂貴。例如,Nusinersen第一年的費用為75萬美元,隨後幾年的費用為37.5萬美元。
5.2
機理研究需跟工藝優化齊頭並進
有效靶點的選擇是小核酸藥物開發的根本前提,基於靶標的序列設計是小核酸藥物達到治療效果、避免脱靶效應的關鍵,而任何靶點的選擇都是建立在對於疾病致病機理深刻理解的基礎上。目前,小核酸藥物可針對的靶點仍然十分有限,核酸藥物設計也在不斷探索之中。小核酸藥物具備一定的平台屬性,一旦在遞送系統方面取得突破,那麼未來限制核酸藥物行業拓展的主要因素將是如何尋找關鍵的靶點。
六、 總結與觀點:具有化學修飾和藥物遞送核心技術平台的企業值得關注
小核酸藥物獨特的靶點和作用機制使其在“不可成藥”或“不可靶向”疾病的治療藥物開發領域具有巨大的潛在價值。此外,與傳統的小分子藥物和抗體藥物相比,小核酸藥物在研發週期、藥效持續性、臨牀開發成功率、特異性等方面也具有顯著的差異化優勢。在經歷了四十餘年的探索發現和曲折發展之後,隨着核酸修飾和遞送技術的突破,小核酸藥物迎來了快速發展的黃金時期。此外,mRNA疫苗在疫情期間的優異表現也讓小核酸藥物成為醫藥行業和資本市場關注的焦點。未來幾年,隨着小核酸藥物向腫瘤、遺傳代謝疾病、罕見病等治療領域不斷拓展,行業市場也將進入快速增長階段。但同時,現階段小核酸藥物行業的發展仍處於初級階段。短期來看,化學修飾和遞送系統仍將是限制小核酸藥物開發的主要瓶頸,也是企業的核心競爭力所在。長期來看,靶點的發現和選擇將是小核酸藥物適應症拓展的關鍵,因此,對於疾病致病機理研究的同樣至關重要。
投資方面,從生命週期來看,我國的小核酸藥物行業尚處於導入期階段,技術創新是現階段這個行業最主要的驅動力。短期內,限制小核酸藥物開發的最大技術障礙仍將是化學修飾和藥物遞送。目前,小核酸藥物開發過程中所應用到的化學修飾位點、分子、化學反應多種多樣,所使用的遞送系統在組成、尺寸、結構、作用機制和最終效果上也各有差異。這種多樣性反映了研究者們對於小核酸藥物性質、作用機制及其在體內的轉運代謝過程的研究不斷深入,同時也意味着小核酸藥物在遞送領域尚有巨大的創新空間。由於無論是化學修飾還是遞送系統都具有平台性,在這兩方面具有技術優勢的企業能基於技術平台快速開發出多樣化的產品管線,建立競爭壁壘,從而更容易在這一賽道中脱穎而出。在潛在標的企業篩選過程中,核心研發人員經歷以及產品管線的體外、臨牀前及臨牀數據的質量可在一定程度上反映技術平台的可驗證性和研發的可持續性,理應是關注的重點。此外,小核酸藥物的快速發展也將帶動上游CDMO企業,擁有小核酸合成和提純技術、核酸藥物製劑穩定放大生產工藝的CDMO企業同樣具備發展潛力。
附錄:我國小核酸藥物領域的初創企業
(1)艾博生物(mRNA)
蘇州艾博生物成立於2019年 ,專注於mRNA疫苗研發,在分子設計、遞送系統方面擁有核心技術,創始人曾就職於Moderna公司從事mRNA疫苗研發工作,具有多年資深從業經驗和技術背景。2020年6月,艾博生物聯合軍事科學院軍事醫學研究院、沃森生物共同研製的新型冠狀病毒mRNA疫苗進入臨牀I期研究階段,成為中國首個進入臨牀階段的mRNA 疫苗,並於2021年7月進入III期臨牀試驗。同時,其與泰格醫藥合作的海外多中心III期臨牀試驗也正在推進。除此之外,艾博生物也會在2021年推動針對 Beta、Delta 兩個變異株的 mRNA 疫苗進入臨牀。艾博生物已於2021年7月初宣佈建成中國首個符合GMP標準的mRNA疫苗生產基地,在mRNA疫苗領域具有先發優勢。
(2)斯微生物(mRNA)
斯微生物成立於2016年,由美國MD Anderson腫瘤中心的博士團隊歸國創建。在核心技術方面,斯微生物擁有mRNA合成技術平台IVT-mRNA(體外轉錄mRNA),該平台已經可以穩定地合成各種長度和功能的mRNA,並建立了完整的質量控制體系。遞送系統方面,斯微生物開發了LPP(lipopolyplex)納米遞送平台,LPP是一種以聚合物包載mRNA為內核、磷脂包裹為外殼的雙層結構。與傳統的LNP相比,LPP的雙層納米粒具有更好的包載和保護mRNA的效果,並對樹突細胞展現出優異的特異性,在腫瘤疫苗開發領域具有較大潛力。公司的mRNA藥物主要涵蓋傳染病和腫瘤兩個領域。
(3)深信生物(mRNA)
深信生物成立於2019年,專注於預防性和治療性mRNA疫苗及藥物的開發。深信生物的核心競爭力在於其新一代LNP遞送系統。公司的AI平台能夠分析優化合成的LNP結構和活性數據,找到best-in-class的LNP結構。深信生物已構建了近5000個LNP庫,可用於篩選適用於不同治療場景的LNP載體,為後續mRNA產品管線的持續研發創造了極好的條件。憑藉其領先的LNP遞送技術平台,深信生物在傳染病、罕見病、腫瘤治療性疫苗、腫瘤免疫治療增強劑等四大方向構建了研發管線。
(4)聖諾生物(siRNA)
蘇州聖諾生物註冊於2008年,是美國Sirnaomics公司在中國的研發與運營主體,創始人陸陽博士是最早投身RNAi領域的產學界專家之一。公司擁有多肽納米顆粒 (PNP) 及新型GalNAc遞送平台。PNP 遞送平台有望通過局部或靜脈給藥,將siRNA及mRNA遞送至除肝臟之外的靶器官患病細胞;而新型GalNAc遞送平台能夠實現對肝臟細胞高效、特定的siRNA藥物遞送。同時,兩種遞送平台還能夠敲低兩個不同的靶基因,以此產生協同效應。聖諾的管線適應症涵蓋了癌症、纖維化疾病、代謝疾病和病毒感染等多種疾病,研究進度最快的核心候選產品STP705已進入II期臨牀階段,用於治療原位鱗狀細胞癌和非黑色素瘤基底細胞癌。
(5)瑞博生物(ASO、siRNA)
瑞博生物成立於2007年,致力於小核酸藥物研究和開發。公司開發出了核酸製藥每個環節的關鍵技術,如siRNA候選序列的設計、活性篩選、核酸化學修飾、脱靶效應及免疫刺激反應評價、核酸化學以及生物分析方法、核酸製備工藝、中間體及藥品質量研究、核酸給藥技術及載體制備等,形成了較為完整的小核酸製藥技術鏈和藥物研發支撐體系。同時,還建立了包括核酸單體、原料藥、藥物遞送載體和藥物產品的工業生產能力。公司與跨國企業展開廣泛合作,搭建了豐富的小核酸藥物產品管線,適應症涵蓋感染、腫瘤、代謝、心腦血管和神經等多個疾病領域,包括針對乙型肝炎、高血脂症等適應症的siRNA療法。目前,公司已有4款產品處於臨牀研究階段和臨牀試驗申請階段,有10餘款產品處於臨牀前或早期發現階段。
(6)中美瑞康(saRNA)
中美瑞康成立於2016 年,由RNA激活領域的開拓者李龍承教授創立,是國內少有的專注於saRNA藥物開發的企業。中美瑞康建立了擁有獨立自主知識產權的saRNA藥物發現與開發平台,擁有10多個新藥項目的研發管線,涵蓋基因遺傳病、腫瘤疾病、靶點在肝臟的代謝及血液系統疾病、皮膚疾病等領域。
(7)鋭博生物(小核酸藥物CDMO)
鋭博生物擁有15年以上RNA合成與開發經驗,專注於核酸藥物(包括siRNA、反義核酸、miRNA、CRISPR及其它)的開發和生產,提供業界領先的一體化核酸藥物CDMO/CMO服務,是國內第一家做寡核酸藥物的CMO/CDMO公司,也是國內首個獲得藥品生產許可證的GMP寡核酸生產基地。公司目前擁有核酸藥物生產、核酸分析檢測平台、高通量測序、核酸新藥研發等八大平台,提供包括RNAi、miRNA、lncRNA、細胞組織分析、生物芯片、高內涵篩選、生物信息學等十大類40多種產品及50多種服務。


