作者 | 東北一度
數據支持 | 勾股大數據(www.gogudata.com)

去年以來,全球範圍內mRNA新冠疫苗的成功研發與大規模使用,使得RNA藥物開始走進大衆視野。實際上,在日益發展的核酸藥物矩陣中,mRNA只是其中一類。隨着靶點發現、技術的進步和化學修飾、遞送技術的成熟,核酸藥物正在快速成爲一個主要的治療板塊。
當前在港股生物醫藥板塊中,尚無一家公司專注於RNA類型藥物研究。但聖諾製藥的到來有望填補港股市場在專業核酸藥物研發企業投資上的空白,7月15日,聖諾生物正式向港交所遞交招股書申請主板上市。本文將初步探討核酸藥物的行業情況。
核酸藥物直指生命本質
核酸是由許多核苷酸聚合成的生物大分子化合物,爲生命的最基本物質之一。根據化學組成不同,核酸可分爲脫氧核糖核酸(DNA)和核糖核酸(RNA)。DNA是儲存、複製和傳遞遺傳信息的主要物質基礎,RNA在蛋白質合成過程中起着重要作用。
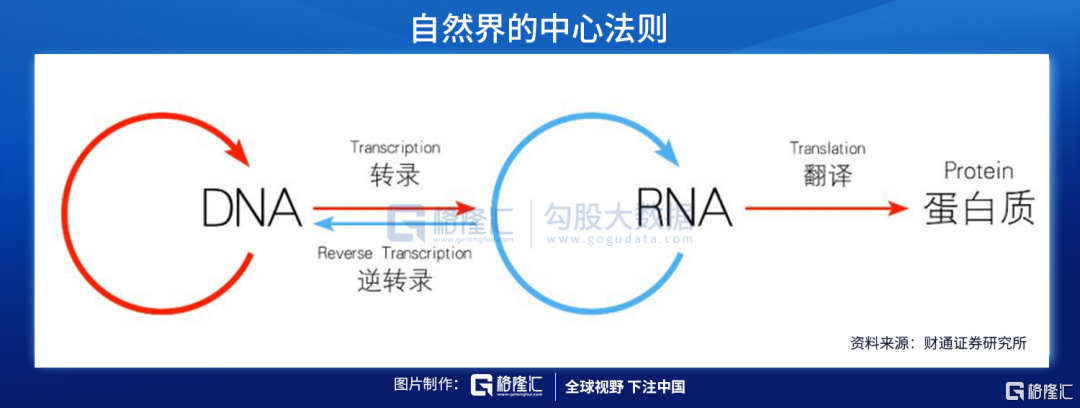
核酸藥物則是各種具有不同功能的寡聚核糖核苷酸(RNA)或寡聚脫氧核糖核苷酸(DNA),能夠直接作用於致病靶基因或者靶mRNA,在基因水平上發揮治療疾病的作用,如由於基因突變可能引起某個重要功能基因的轉錄變化,導致相應的蛋白出現過多、過少表達或者突變,誘發特定疾病,核酸藥物從轉錄後水平進行基因沉默或激活治療,相比傳統蛋白水平發揮作用的藥物具有高特異性、高效性、長效性等明顯優勢。
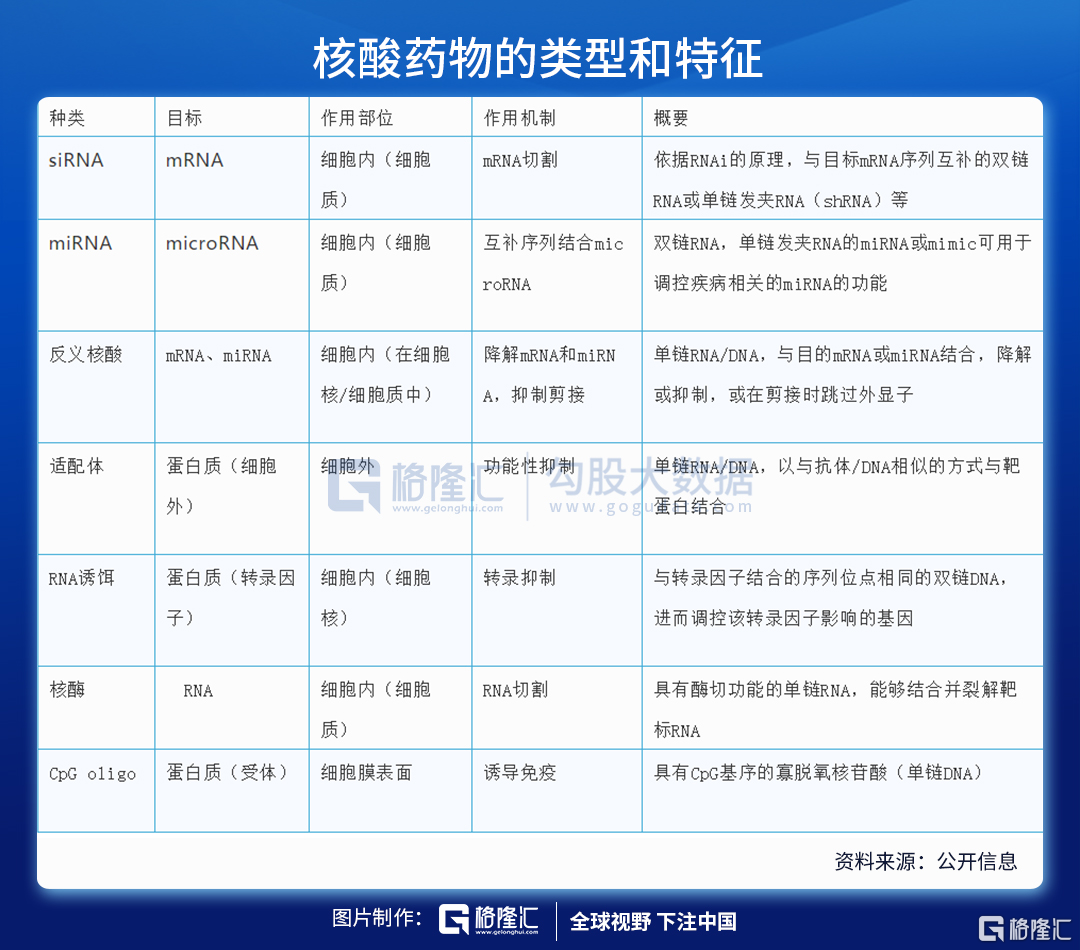
核酸藥物包括反義核酸(ASO)、小幹擾RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)適配體(aptamer)、核酶(ribozyme)、抗體核酸偶聯藥物(ARC)等,是基因治療的一種形式,也是繼小分子藥物、蛋白藥物、抗體藥物之後的新一代製藥技術。
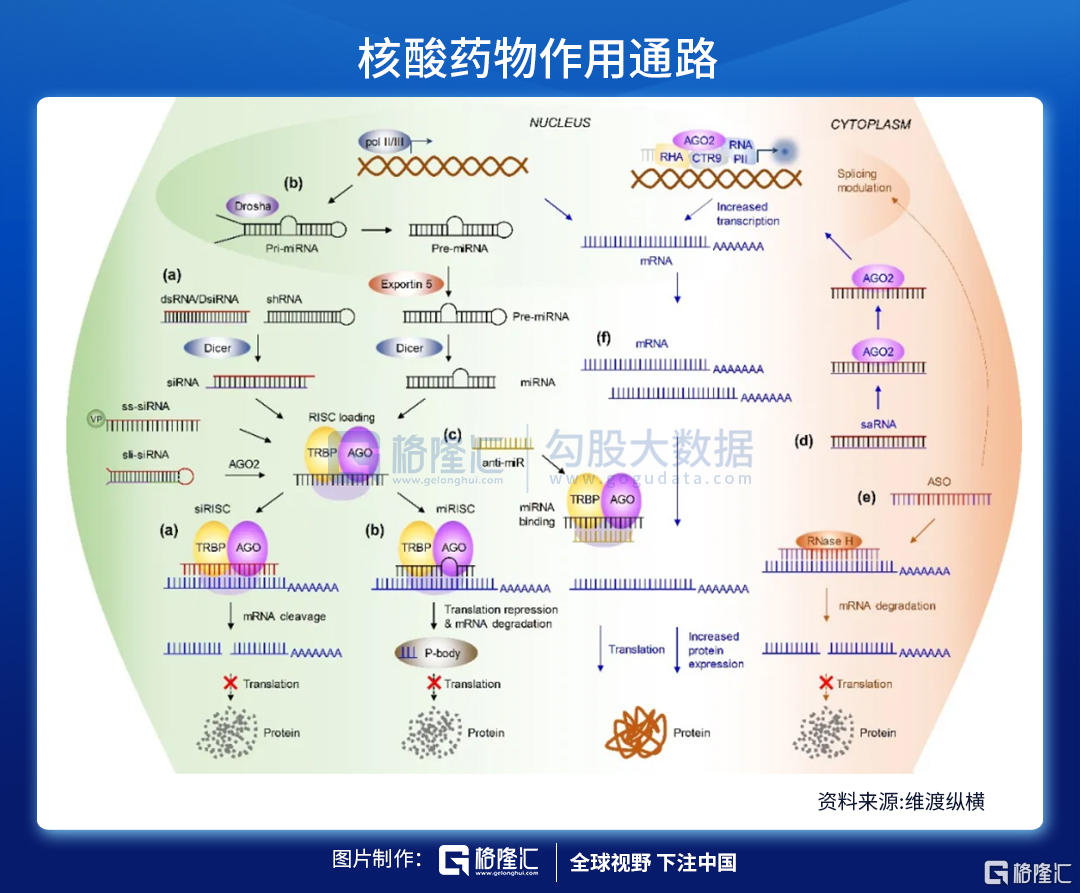
注:(a)小幹擾RNA(siRNA)與(b)微小RNA(miRNA)的作用通路;(c)miRNA拮抗核酸作用機制;(d)小激活RNA(saRNA)的工作模式;(e)反義核酸(ASO)作用方式;(f)信使RNA(mRNA)療法的特點
核酸藥物可以大大提升靶點數量
小分子化藥和抗體藥物通過與靶點蛋白結合發揮治療作用,但可成藥的靶點蛋白數量有限。自上世紀80年代後,基於靶點的新藥研發逐漸展開,並發現了大量的新藥;傳統的小分子化藥和抗體藥物均是通過與靶點蛋白結合而發揮藥理作用,靶點蛋白可以是酶、受體、離子通道等。
儘管小分子化藥有易生產、可口服給藥、藥代動力學性質更佳、易通過細胞膜等優勢,但是其研發受到靶點可成藥性(druggable,與靶點蛋白是否有合適的口袋結構、大小、深淺、極性等有關)的限制;據Nature 2018的一篇文章報道,人類基因組編碼的~20,000種蛋白質中,僅有3,000種是可以成藥的,且只有700種有相應的藥物研發出來(以小分子化藥爲主)。
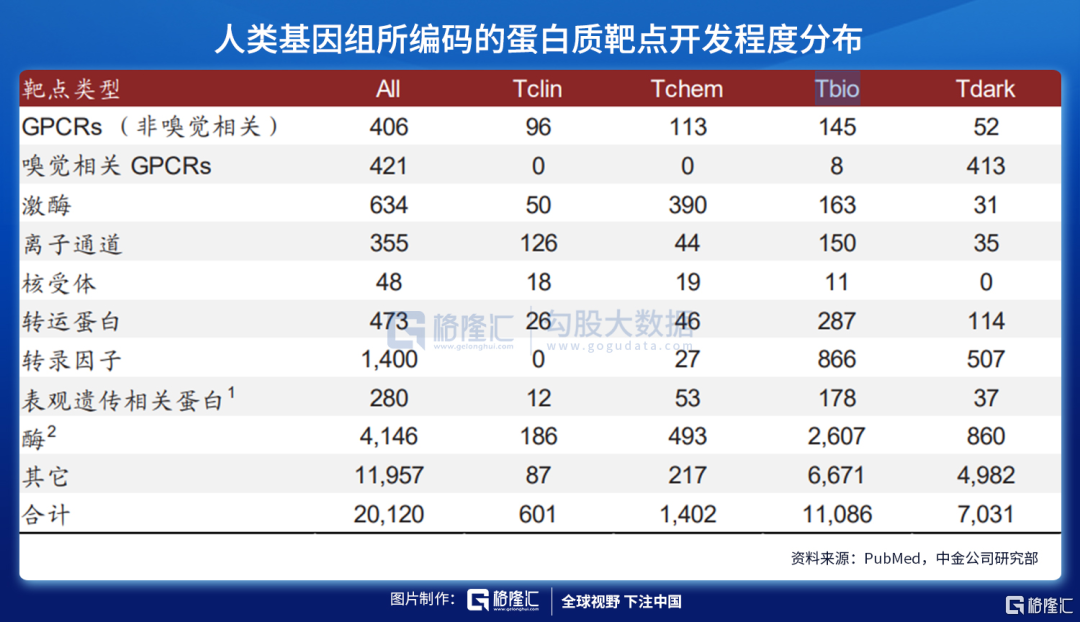
注:GPCR, G protein-coupled receptor;1包括40種轉錄因子;2不包括激酶
Tclin蛋白:與至少一種已獲批藥物相關聯的藥物靶點
Tchem蛋白:確認與小分子結合具有高親和力
Tbio蛋白:對其具有一定的生物學理解水平,但缺乏小分子結合物
Tdark蛋白:對其特徵理解非常有限
同時,抗體類藥物可作用的靶點位置受到限制。在小分子藥物之後,以抗體藥物爲主的生物藥逐漸出現,與小分子化藥相比,抗體藥物可作用的靶點蛋白種類更多,且可通過蛋白質工程技術提升其親和性降低毒性等。但是抗體類藥物擁有分子結構更加複雜、生產成本更高、通常需通過注射給藥等劣勢,並且抗體藥物通常只能與細胞膜表面或細胞外的蛋白質發揮作用,使得其應用受到一定限制。
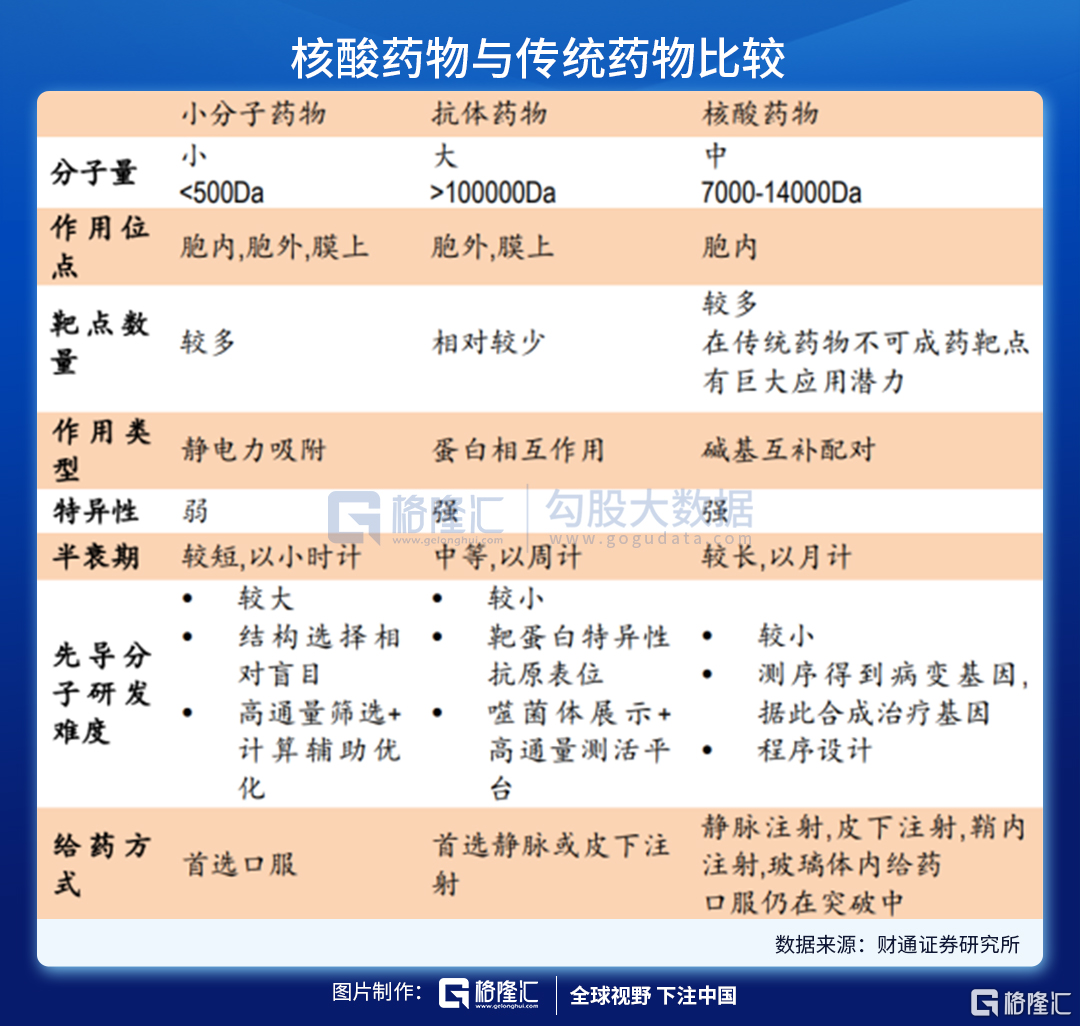
相比之下,核酸類藥物擁有明顯的優勢。核酸類藥物可基於鹼基互補原理對錶達相關蛋白質的基因進行調節,如ASO、siRNA、miRNA、saRNA等,而非與靶點蛋白質進行結合,且通過合適的遞送系統可使其進入細胞內發揮作用,因此核酸藥物可避免傳統小分子化藥和抗體類藥物面臨的不可成藥靶點的限制問題,而且對胞內外和細胞膜蛋白均可發揮調節作用。
另外,多數核酸類藥物的作用基礎是鹼基互補配對原則,只需知道靶基因的鹼基序列,核酸藥物的序列設計就十分容易,化學修飾和遞送系統的設計與序列的設計是相對獨立的;相比之下,小分子和抗體藥物的發現和優化過程中,對活性、PKPD等性質的優化均需要對結構做改動,需要花費大量的工作。
核酸藥物遞送是研發的難點
但是核酸藥物多年來發展曲折,在覈酸藥物的開發領域主要面臨三大問題:
1.核酸分子,特別是RNA在體內不穩定性;
2.潛在的副作用;
3.藥物遞送系統(DDS)的困難等。
也就是說,核酸藥物富有挑戰的是其注射進入人體後,如何存留足夠時間以準確靶向到病變部位,同時避免損傷正常細胞,歸根結底是研發出高效安全的藥物遞送系統,以解決核酸藥物遞送、穩定性、脫靶效應等難題。
但隨着新技術的發展,部分難題已經有較好的解決辦法,其中化學修飾和遞送系統技術的突破對核酸藥物的發展起到了至關重要的作用。儘管化學修飾可以改善核酸藥物的穩定性和免疫原性,核酸藥物需進入細胞內纔可以發揮作用,由於核酸藥物分子量較大且通常帶負電荷,因此被細胞攝取的效率和內吞體逃逸的效率比較低,因此需藉助遞送系統的力量。
遞送系統可分爲病毒載體和非病毒載體,病毒載體在基因治療中應用較多,但由於其免疫原性、致瘤性、和有限的載藥量(loading capacity)使得其在覈酸藥物中應用相對較少;而非病毒載體應用相對更多,如聚合物類(polymer)、脂質類(liposome 或 LNP);且可以將核酸藥物與特定的配體結合使其能夠靶向特定的細胞,如 GalNAc、多肽、抗體等。
目前常有的遞送方案包括:納米脂質體、陽離子聚合物、GalNac糖基化修飾等。未來,這一領域的發現將會有力的推動核酸藥物的發展。
脂質類是目前核酸藥物中研究應用最多的遞送系統之一,且已經有使用脂質納米顆粒遞送系統的核酸藥物獲批,根據其性質和結構的不同其可以分爲脂質體(liposome)、脂質納米顆粒(LNP,lipid nanoparticle)等,目前研究中用的較多的包括含有可離子化脂質的LNP等。
聚合物類遞送系統也常用於藥物遞送,陽離子聚合物可中和核酸藥物的負電荷以提升進入細胞的效率,聚合物可以進行多種化學改造,而且可以與多種藥物或配體兼容(compatibility)。聚合物可以做成線狀或分枝狀,PEI(polyethyleneimine)被應用於siNRA藥物的遞送。
儘管脂質類遞送系統促進了核酸藥物的發展,脂質類遞送系統體積較大,更容易進入肝、腎的空隙較大的組織,且依然會有免疫原性,有時需與糖皮質激素類藥物同時使用。核酸偶聯遞送是指將核酸藥物與遞送材料偶聯,如膽固醇、多肽、抗體、核酸適配體或小分子結構等,利用遞送材料的性質將核酸藥物送至細胞內。
GalNAc是目前常用的核酸偶聯遞送系統之一。與脂質類載體相比,核酸偶聯物分子量相對較小,因此體內生物分佈的性質更佳,而且通過偶聯物的設計可以使其靶向特定的組織和細胞,同時採用對酸敏感的linker設計可以使核酸偶聯物在通過內吞體進入細胞之後與偶聯物脫離。其中GalNAc是目前應用較爲成功技術之一,已經有3款基於GalNAc技術的核酸藥物獲得FDA或EMA的批準。
相關企業
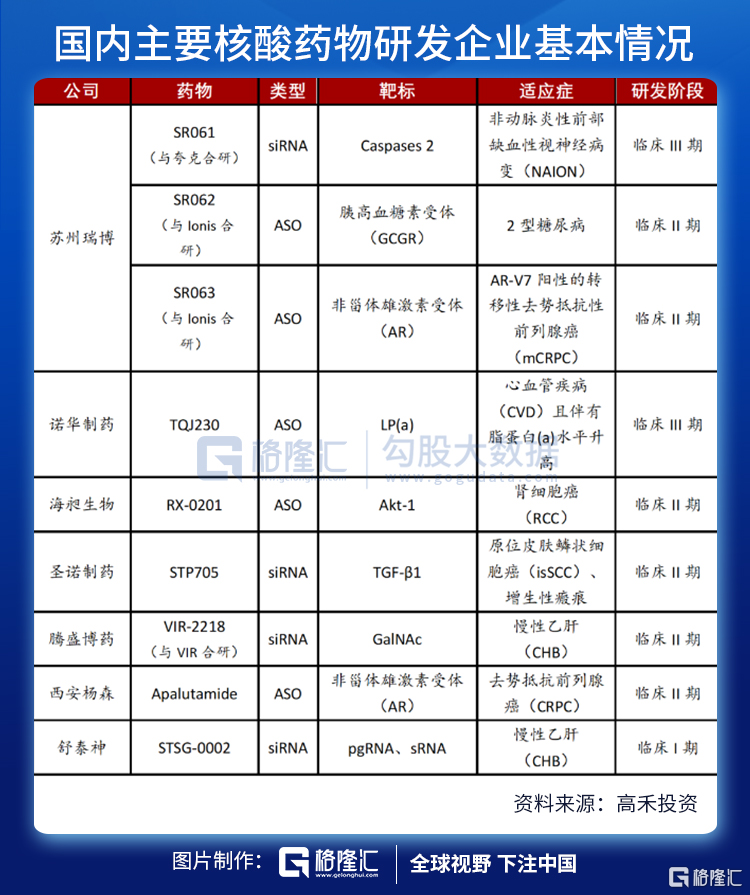
儘管國外核酸藥物領域如火如荼,國內由於技術的限制,涉足核酸藥物的公司屈指可數。據統計,截至2021年7月1日,國內藥企研製的小核酸藥物項目IND已獲批並進入臨牀階段的共有9個,其中5款ASO藥物,4款siRNA藥物,涉及的疾病領域包括抗病毒、代謝性疾病和心血管疾病等。
藥物公司包括瑞博生物、聖諾製藥、天龍藥業、中美瑞康、斯微生物、彭濟凱豐、西安榮清暢、復星醫藥、舒泰神、綠葉製藥、香雪製藥、艾棣維欣、美諾恆康、步長製藥。
CRO/CDMO包括吉凱基因、吉瑪基因、銳博生物、百奧邁科等。