2021年6月,國內首款CAR-T產品獲批,國內細胞治療開始進入爆發期。根據粵開證券數據統計顯示,2020年國內已經臨牀階段的CAR-T試驗數有335個,那麼在諸多創新藥企爭相佈局的賽道中,應當如何看待細胞治療領頭羊藥明巨諾-B(2126.HK)?
細胞治療:壁壘性高,市場增速快
從市場格局上來看,CAR-T細胞療法全球以及中國均處於高速爆發時期。根據Frost&Sullivan數據統計顯示,海外市場上,隨着2017年的兩款CAR-T產品(Yescarta 和Kymriah)獲批以來,CAR-T細胞療法全球市場規模從2017年的1300萬美元增長到2019年的約7.39億美元。在中國市場上,國內CAR-T細胞療法市場規模預計從2021年6億元爆發式增長至2030年的243億元人民幣,複合增速達到44.5%。
圖表一:中國細胞治療CAR-T市場規模預測
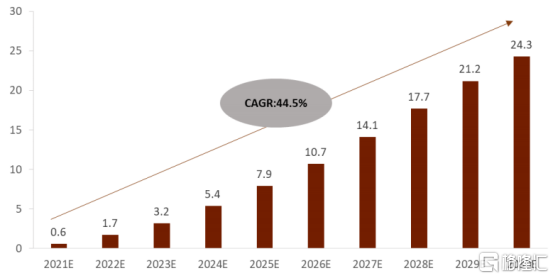
數據來源:Frost&Sullivan,格隆彙整理 單位:10億元人民幣
在賽道處於高速爆發期之時,並非人人都能分其一杯羹,細胞治療相比起其他腫瘤治療,在技術以及生產上具有更高的壁壘性。從歷史發展的角度來看,科學界的研究已經逐步從化學藥發展為生物藥,乃至於更加新興的細胞治療方式。相較於生物藥,細胞治療研發技術難度大,對於生產體系的要求更高,生產環境更加複雜(例如病毒表達系統,細胞活性等問題),對於儲存的條件更為苛刻。
而細胞治療的高門檻也造成了對於正在佈局的藥企有着更高要求。換言之,伴隨着細胞治療技術開始步入商業化,由於存在生產、儲存等一系列的壁壘性,頭部核心企業的綜合能力顯得更為重要,也更容易在競爭中脱穎而出。
藥明巨諾:細胞治療領域的領頭羊
藥明巨諾是一家領先的細胞療法平台公司,致力於開發、製造和商業化潛在的同類最佳細胞療法。
從產品管線來看,藥明巨諾擁有多款CAR-T細胞治療產品,涵蓋血液惡性腫瘤和實體腫瘤領域,在CD19、BCMA、AFP、GPC3等靶點均有佈局,擁有強大的製備和研發能力。其中,藥明巨諾的核心產品relma-cel(瑞基奧侖賽注射液)用於瀰漫性大B細胞淋巴瘤的三線治療上市申請於2020年6月獲得NMPA受理,並納入優先審評,有望成為國內第二個獲批上市的CAR-T產品。
圖表二:在研產品管線

數據來源:藥明巨諾公司官網,格隆彙整理
1. Relma-cel(JWCAR029,瑞基奧侖賽):已申報上市,BIC
藥明巨諾的核心產品relma-cel(JWCAR029,瑞基奧侖賽),一款靶向CD19的CAR-T 產品,在B細胞血液腫瘤方面有廣泛應用,包括瀰漫性大B細胞淋巴瘤(DLBCL)、濾泡淋巴瘤(FL)、套細胞淋巴瘤(MCL)、慢性淋巴白血病(CLL)以及急性淋巴細胞白血病(ALL)。
從臨牀數據上來看,relma-cel有望成為靶向CD19的CAR-T中的Best-in-Class產品。根據藥明巨諾在2020年ASH年會上公佈的用於治療DLBCL的關鍵性臨牀試驗數據來看,相較於已經獲批的Kymriah和Yescarta,藥明巨諾的relma-cel療效更佳(ORR: 75.9%,CR: 51.7%),安全性更好(CRS:5.1%,NT:5.1%,均為≥3級數據)。
圖表三:CAR-T藥物治療DLBCL臨牀數據對比
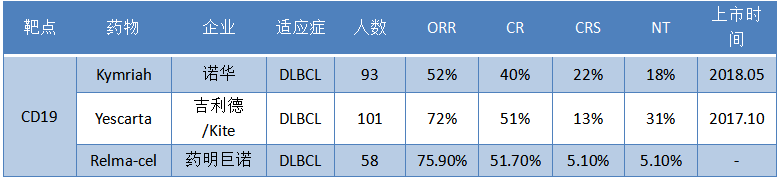
數據來源:ASH,格隆彙整理 注:CRS以及NT為≥3級數據
從研發進展上來看,relma-cel是國內第一款進入臨牀試驗階段的 CAR-T 產品,有望成為首個獲准上市的I類新藥細胞治療產品。目前國家藥品監督管理局正在審批relma-cel 用於瀰漫性大 B 細胞淋巴瘤(DLBCL)三線治療的新藥申請,近期有望獲批上市。2020年9月,國家藥品監督管理局已向藥明巨諾授予 relma-cel 新藥申請優先審評資格,該產品亦是目前唯一獲得了國家“重大新藥創制”專項、優先審評和突破性療法認定三項殊榮的CAR-T細胞藥物,現正處於上市審評審批中。。
除了三線DLBCL適應症外,relma-cel 在用於治療三線濾泡性淋巴瘤(FL)和三線套細胞淋巴瘤(MCL)處於註冊試驗階段,用於瀰漫性大 B 細胞淋巴瘤二線治療處於 I 期臨牀試驗階段,其他適應症(包括急性淋巴細胞白血病三線治療和慢性淋巴細胞白血病三線治療)目前正處於臨牀前研究階段。根據中金預計,relma-cel 有望於 2021 年投放市場,風險調整後的銷售額有望在 2031年達 47.6 億元人民幣的峯值。
2. JWCAR129:BCMA靶點,臨牀試驗獲NMPA受理
7月6日,藥明巨諾的第二款CAR-T療法JWCAR129的臨牀試驗申請獲得NMPA受理。
JWCAR129是一款靶向 B 細胞成熟抗原(BCMA)的 CAR-T 產品,用於治療多發性骨髓瘤(MM)。根據藥明巨諾的計劃,在進行劑量遞增試驗後,開展一項多中心註冊 II 期試驗,用於治療先前已經經歷至少三次失敗治療的複發性或難治性多發性骨髓瘤患者。此外,藥明巨諾計劃進一步開發以評估 JWCAR129 用於多發性骨髓瘤二線治療或與其他藥劑聯合使用。按照中金預測,JWCAR129在經風險調整後的銷售額有望在 2032 年達到 9.07億元人民幣的峯值。
3. JWATM203 和 JWATM204 :TCR-T細胞療法,佈局實體瘤領域
雖然CAR-T在血液腫瘤治療中開始大放異彩,但常規的CAR-T療法在用於治療實體瘤領域仍然存在諸多挑戰。目前,藥明巨諾已經通過與全球領先的細胞療法企業合作,建立了包括ARTEMIS平台、E-ALPHA平台和Lyell平台在內的差異化細胞療法平台,專注於實體瘤領域的前沿科學研究。
基於前沿的科學平台,藥明巨諾建立了差異化的T細胞療法產品組合,包括JWATM203 和 JWATM204 項目。其中,JWATM203是以甲胎蛋白AFP為靶點的潛在同類最佳TCRm T 細胞療法,JWATM204 是以磷脂酰肌醇蛋白聚糖-3(GPC3)為靶點的新型 T 細胞療法候選產品,二者均用於治療肝細胞癌。
4. 生產優勢:製造成功率高,有望更多患者受益
隨着細胞治療開始走進商業化進程的時代,如何將在研產品成功轉化成產品送入患者手中成為十分重要的一環。
從產能上來看,藥明巨諾已經建立了領先的商業製造基礎設施和供應鏈。藥明巨諾位於外高橋和張江地區的臨牀生產設施面積約為 600 平方米。蘇州新的 cGMP 標準商業生產基地面積約 9,976 平方米,主要用於滿足藥明巨諾從臨牀規模生產擴大到商業規模生產的需求,現有產能滿足每年2500例自體CAR-T產品的製備。
從生產成功率來看,根據FDA數據統計顯示,相較於其他同類獲批產品,藥明巨諾核心產品relma-cel具有更高的製造成功率。從relma-cel的註冊試驗中來看,其在整個瀰漫性大 B 細胞淋巴瘤註冊 II 期試驗過程中的生產成功率達到100%,遠高於已經獲批的三家企業。換言之,藥明巨諾的高生產成功率意味着一旦獲批上市,將會有更多的患者能夠受益其中,也將會為公司業績爆發保駕護航。
圖表四:Relma-cel與其他獲批的靶向CD19的CAR-T產品的製造成功率
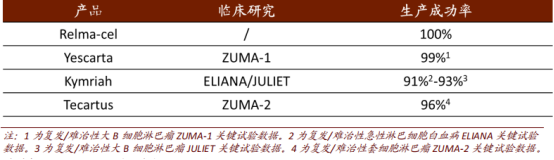
數據來源:FDA,中金公司,格隆彙整理
小結
如果説2017年是細胞治療的元年,那麼2021年將會是國內細胞治療大爆發的開始之年。
從行業情況來看,高速增長的細胞治療賽道,擁有比生物藥更高的壁壘性,也就意味着對於參與其中的玩家提出了更高的要求,走在前沿的公司將會獲得市場紅利部分。而不可否認的是,復星凱特網傳的定價策略,在一定程度上將醫藥熱的投資拉回了理性的範疇之中。換言之,在選擇好的賽道之下,應該選擇無論是在生產,銷售還是創新能力上的優質公司,才能獲取穩定持久的超額收益。
對於藥明巨諾而言,無論是在血液瘤上即將獲批的relma-cel還是已經在實體瘤領域的佈局,都在證明其強勁的研發實力。而在後續的商業化中,在生產環節成功率高。在生產成本上,目前藥明巨諾已經正在推進降成本的戰略,未來會系統性地大規模降低成本。這些都將會為藥明巨諾未來業績爆發提供有利保障。
從資本市場的角度來看,每一個里程碑事件都有望轉化成藥明巨諾股價的催化劑,帶來新一輪的上揚。而作為新興的創新藥企,藥明巨諾受到包括中金以及興業證券等多家券商機構看好。其中,中金證券給予藥明巨諾“跑贏行業”評級,2021年合理估值172.2億港元,目標價43.69港元,較藥明巨諾目前股價存在94.61%的上行空間,安全邊際高,未來值得長期關注與期待。




