近日,記者從相關渠道獲悉,在獲批上市僅30天內,基石藥業胃腸道間質瘤(GIST)精準靶向藥泰吉華®(阿伐替尼片)在北京大學腫瘤醫院、北京大學人民醫院、上海交通大學醫學院附屬仁濟醫院等近三十家醫院同步開出首批處方單,並正式面向全國多個省市的五十多家院內和院外藥房供藥。這標誌着泰吉華®作為中國首個獲批用於治療PDGFRα外顯子18突變(包括PDGFRα D842V突變)的胃腸道間質瘤的創新藥開始正式惠及中國患者。

胃腸道間質瘤是發生於胃腸道的肉瘤,肉瘤是發生在骨內或源自結締組織的腫瘤。每年中國約有1-1.5/10萬(1.4萬-2.1萬)新診斷患者。約90%胃腸道間質瘤患者的致病因素與KIT(外顯子11 JMD 突變)或血小板衍生生長因子受體(PDGFRα)基因突變有關,85%以上的胃腸道間質瘤屬於KIT基因突變激活,5%為PDGFRα 基因突變。其中PDGFRα外顯子18突變約佔1.2%-12.8%。
數據顯示,這類患者對現有的已批准的KIT藥物均不敏感。並且,GIST起病隱匿,容易被常規檢測手段忽略,患者往往確診時已屬中晚期階段,並且原發耐藥性突變和多線靶向治療後的耐藥進展使得GIST患者在治療上存在着巨大的未被滿足的需求。因此,業界認為,泰吉華®在全國多地開出處方單,無疑為國內GIST患者提供了新的治療方案。
阿伐替尼中國研究的主要研究者,北京大學腫瘤醫院副院長沈琳教授表示,多年來,胃腸道間質瘤的大眾知曉度和社會關注度都比較低,許多PDGFRα外顯子18突變的GIST患者更是缺乏治療藥物,臨牀急需精準藥物延長這部分患者的生存期。泰吉華®在中國大陸的處方落地,對提高國內GIST治療現狀具有重要意義。另外,北京大學人民醫院胃腸外科主任葉穎江教授、上海交通大學醫學院附屬仁濟醫院普外科主任曹暉均表示,此次泰吉華®在全國多地開出處方單,將為國內GIST患者治療提供新選擇,進一步助力患者改善預後、提高患者生活質量。

北京大學腫瘤醫院副院長沈琳教授開具處方



值得注意的是,受益於優先評審等多項政策,泰吉華®從獲批到多地實現供藥只用了30天。去年7月份,泰吉華®得NMPA優先評審資格並於3月底正式獲批。此前,阿伐替尼成功入選首版《CSCO胃腸間質瘤診療指南》,使得我國對於PDGFRα D842V突變患者治療首次有了指南級證據,GIST治療進入以驅動基因為基礎的精準治療新時代。
為推進泰吉華®在中國獲批上市進入臨牀應用後的商業化進程,目前,基石藥業已經與國藥控股股份有限公司、上海鎂信健康科技有限公司、北京圓心科技集團有限公司等合作伙伴簽署戰略合作協議,旨在滿足中國腫瘤患者在藥物可及性、支付可及性、服務可及性、用藥依從性等方面的迫切需求。
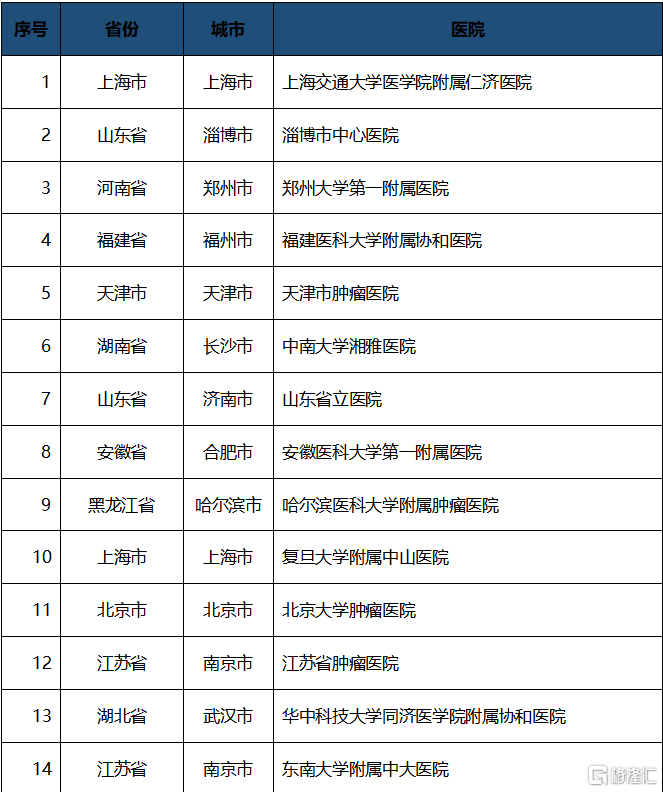
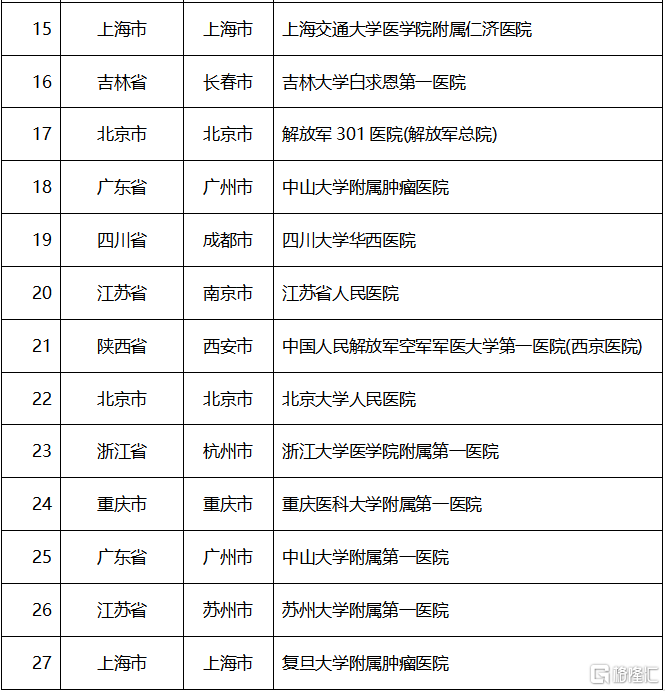
開具首批處方的醫院包括: