12月28日,永泰生物-B(6978.HK)發佈公吿,其在研產品CAR-T-19注射液以B細胞急性淋巴細胞白血病(B-ALL) 為臨牀適應症,已獲得國家藥品監督管理局藥品評審中心批准新藥臨牀試驗(IND)申請,可以進行臨牀試驗,預計2021年開展臨牀試驗。受公吿利好影響,永泰生物-B(6978.HK)高開高走,最高漲幅達到11.02港元/股,截至當日收盤,收盤價11.00港元/股,漲幅達到7.84%,創公司近3個月新高。
圖表一:永泰生物走勢圖
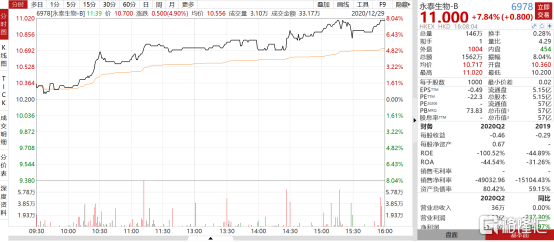
數據來源:WIND,格隆彙整理 數據截至2020年12月29日
中國細胞免疫治療迎來十年爆發期
腫瘤疾病,人類死亡的一大殺手。伴隨着科技技術的發展,細胞免疫治療方式正在引領抗癌治療進入新的時代。
與傳統的癌症治療藥物不同,CAR-T 細胞療法主要是利用 T 細胞啟動人體自然宿主防禦機制。CAR-T 可以在識別腫瘤抗原時無需主要組織相容性複合體(MHC)的限制,能夠識別 MHC 非依賴型靶標,同時通過共刺激性分子信號增強 T 細胞免疫的殺傷性,從而克服由於腫瘤細胞下調 MHC 表達或抑制共刺激分子分泌而造成的免疫逃逸。
CAR-T 療法在血液腫瘤方面取得顯著進展,尤其是在 CD19-CAR-T 方面。CD19 表達於大多數B系淋巴瘤細胞,而不存在於造血幹細胞和正常組織中。根據目前全球已完成及正在進行的 CAR-T 臨牀試驗,以 CD19 作為靶點接近一半,CD19 已成為當前 CAR-T 免疫治療最重要的分子生物標誌物。
圖表二:CAR-T細胞療法應用癌症領域(圖左)與設及靶點(圖右)
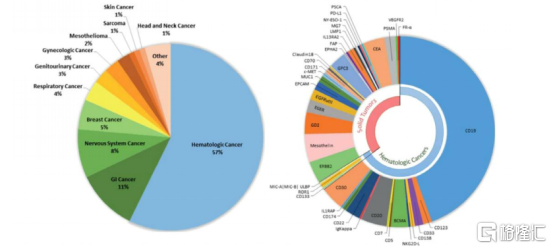
數據來源:F. Arabi et al,山西證券,格隆彙整理
從市場規模上來看,中國細胞免疫治療將在未來十年中迎來黃金時期,帶來爆發式增長。根據Frost&Sullivan數據統計顯示,中國細胞免疫治療產品市場規模預計2021年至2023年由13億元增長至102億元,複合年增長率達到181.5%。
圖表三:中國細胞免疫治療市場規模
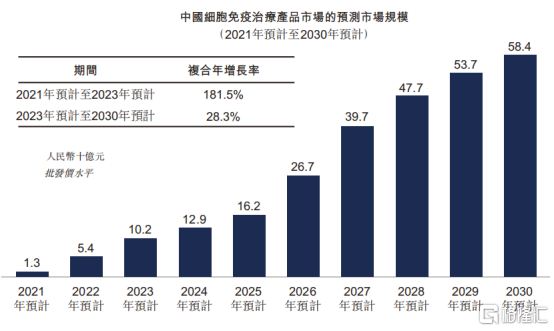
數據來源:Frost&Sullivan,格隆彙整理
細胞治療有望為ALL帶來希望
白血病是一類造血幹細胞惡性克隆性疾病。根據白血病的分化程度、自然病程的長短可分為急、慢性白血病。
其中,急性淋巴細胞白血病(ALL)是急性白血病的亞型之一,在兒童中比較常見。急性淋巴細胞白血病(ALL)主要表現在未成熟的血細胞數量快速增加,而其血細胞的DNA被破壞,並且不能生長成為正常細胞。
根據Frost&Sullivan數據統計顯示,ALL患者的新增病例從2014年的1.16萬例增加至2018年的1.24萬例,年複合增長率達到1.7%,預計2030年將達到1.47萬例。2018年,在中國 約 有10,700名18歲以下兒童新增患上ALL,佔於中國的ALL患者總數86.3%。由於早期篩查的發展,估計於2023年將達到1.34萬例,於2030年將達到1.47萬例。
在ALL患者中,有75%的CD19陽性表達的B細胞急性淋巴細胞白血病(B-ALL)。根據Frost&Sullivan數據統計顯示,2015年中國約有1.2萬名新增B-ALL患者,其中難治復發型(R/R B-ALL)患者佔30%。
兒童作為常見ALL患病人羣,很難接受傳統高強度長時間的化療方式進行治療,但由於靶點治療和細胞免疫治療副作用相對較少,或許可以成為用於治療兒童的R/R ALL的有效方式,目前細胞免疫治療已經在衞健委頒佈的指南中被推薦用於治療兒童急性淋巴細胞白血病。
CAR-T-19獲批臨牀,有效性與安全性有望更優
2012 年,在 Carl June 的一項針對兒童 B 細胞急性淋巴細胞白血病的 CAR-T 臨牀試驗中,一個名叫 Emily的急性白血病患兒在二次復發無藥可治的情況下,通過靶向 CD19 的 CAR-T 治療,三週後腫瘤完全消失,至今 Emily 依然健康的活着,可以説 CAR-T 創造了人類歷史上的醫學奇跡,給無數癌症患者帶來的新的希望。
2017 年美國 FDA 批准了兩項靶向 CD19 的 CAR-T 細胞療法上市,即諾華的Kmriah和 Kite的Yescarta,分別用於治療兒童和青少年的急性淋巴細胞白血病(ALL)和特定類型的非霍奇金淋巴瘤(NHL)。
而永泰生物此次獲批用於治療B細胞急性淋巴細胞白血病(B-ALL)進入臨牀試驗的CAR-T-19注射液,是公司在CAR-T細胞產品中首款在研產品,成為繼核心在研產品EAL®之後又一獲批開展臨牀試驗的創新藥物。CAR-T-19注射液預計將於2021年展開臨牀試驗。
從公司此前在招股書中披露的體內藥效學實驗來看,在2017年6月至2018年9月期間,在共計63名受試者中,CAR-T-19具有一定的有效性和安全性優勢,相較於其他同類治療產品有望療效更好。具體來看:
(1)客觀緩釋率(ORR)達到98.21%。
(2)完全緩釋率(CR)達到94.64%,遠高於同期目前全球已經上市用於治療r/r ALL的藥物,例如惠氏製藥的Inotuzumab(CR:80.7%),安進的Blinatumomab(CR: 43%),以及諾華製藥的Tisagenlecleucel(CR:81%)。
圖表四:全球已上市的針對r/r ALL的代表藥物
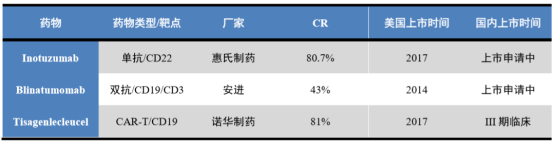
數據來源:Insight,山西證券,格隆彙整理
(3)在有效性上,CAR-T-19在12個月整體生存率高於80%,高於諾華製藥的Kymriah的76%。
(4)在安全性上,細胞因子釋放綜合徵(CRS)是最常見及最嚴重的不良反應,CAR-T-19相較於諾華製藥不良反應率較低,其中大多數反應程度較輕。
圖表五:永泰生物CAR-T-19與諾華產品對比

數據來源:公司招股説明書,格隆彙整理
小結
伴隨着新一輪醫保談判落下帷幕,鼓勵創新研發成為一系列醫改政策的背後邏輯。而以CAR-T為代表的細胞療法,也正在逐步在國內外市場上大放異彩,在未來十年中有望迎來爆發期,國內市場規模在2030年達到584億元。
根據山西證券的預測,假設國內CAR-T治療ALL患者費用為30萬元,CAR-T在國內的滲透率為30%和40%的情況下,針對ALL的市場空間分別為2.34億元和3.12億元。
作為細胞治療第一股,永泰生物在上市之初就吸引了眾多投資者的目光。此次獲批進入臨牀的CAR-T-19,更是在數據上安全性以及有效性上更優,有望為ALL患者帶來希望。隨着CAR-T-19產品進入臨牀試驗,估值有望進一步提升,值得關注與期待。




