專注於抗腫瘤領域的基石藥業-B(2616.HK)已經在港交所上市1年,近日公司公佈首份年報成績單。此前,格隆匯曾在公司發佈2019半年報時發佈公司業績解讀《PD-1/PD-L1賽道,基石藥業(2616.HK)憑什麼彎道超車?》,將公司的研發管線聚焦在備受矚目的PD-(L)1賽道上。然而在公司發佈2019年全年業績上,格隆匯驚喜的發現,公司不僅在核心產品上開始進入新藥申請的產品收穫期,更在內部研發+外部合作雙重驅動下,正在走向2.0版本的產品管線。
產品管線1.0:三大免疫腫瘤骨架藥物資產
基石藥業在研發管線設計之初,就是選取PD-1、PD-L1以及CTLA-4三個靶點作為核心骨架藥物進行研發試驗,並選取更加有效的聯合治療,使得藥物效果發揮更大的作用。
目前,公司共計擁有15種抗腫瘤候選藥物,包括3種處於臨牀階段的腫瘤免疫治療骨架候選藥物(PD-L1、PD-1以及CTLA-4抗體),其中5種處於臨牀後期候選藥物正在進行關鍵試驗。
圖表一:在研產品管線

數據來源:公司公告,格隆彙整理
核心產品CS1001(PD-L1):最快2020年提交新藥上市申請
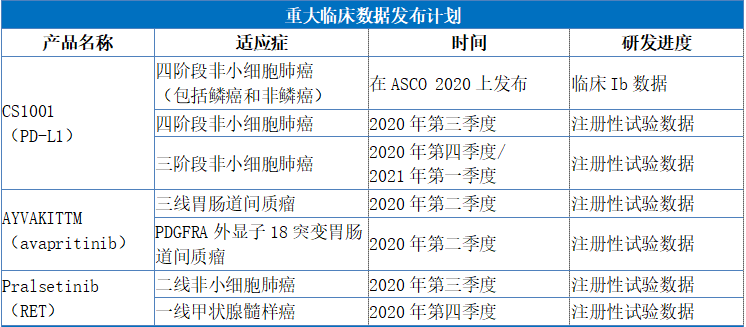
隨着PD-1產品開始納入新醫保目錄,PD-1/PD-L1賽道的競爭也開始愈發激烈。目前國內尚未擁有國產PD-L1獲批,根據Insight數據庫顯示,國內企業臨牀在研的PD-L1抗體共計有15個品種(涉及54個臨牀登記號),其中基石藥業的CS1001(PD-L1)已有6個適應症進入臨牀III期。其中,進展最快包括經典型霍奇金淋巴瘤(cHL)及自然殺傷/T細胞淋巴瘤(NKTL),有望在2020年提交新藥上市申請;而緊隨期後的四期非小細胞肺癌(NSCLC)也取得了良好的臨牀進展,預計於2020年第三季度發佈註冊性試驗關鍵數據。
那麼在過去的一年中,有關CS1001(PD-L1)的研發進展如何?我們來看一組重磅臨牀數據。
以下是2019年基石藥業在中國臨牀腫瘤學會CSCO、歐洲腫瘤內科學會ESMO和美國血液學會ASH三個重要會議上公佈的有關CS1001(PD-L1)重要的臨牀數據情況:
(1)公司在2019年CSCO上公佈CS1001(PD-L1)聯合化療針對食管癌的療效和安全性(臨牀Ib期試驗),客觀緩釋率(ORR)為77.8%,緩釋持續時間(DCR)為88.9%;
(2)公司在2019年CSCO上公佈CS1001(PD-L1)聯合化療針對胃/胃食管交界癌的療效和安全性(臨牀Ib試驗),客觀緩釋率(ORR)為62.1%,緩釋持續時間(DCR)為82.8%;
(3)公司在2019年CSCO上公佈CS1001(PD-L1)作為單藥針對膽管癌/膽囊癌的療效和安全性(臨牀Ib試驗),客觀緩釋率(ORR)為10.3%,緩釋持續時間(DCR)為37.9%;
(4)公司在2019年CSCO上公佈CS1001(PD-L1)作為單藥針對微衞星不穩定性高(MSI-H)/錯配修復缺陷(dMMR)腫瘤的療效和安全性(臨牀Ib試驗),客觀緩釋率(ORR)為38.1%,緩解持續時間(DCR)為57.1%;
(5)公司在2019年ASH上公佈CS1001(PD-L1)作為單藥針對復發/難治性結外自然殺傷細胞/T細胞淋巴瘤(rr-ENKTL)的療效(臨牀II期註冊性試驗)完全緩釋率(CR)為31.8%,客觀緩釋率(ORR)為40.9%。
總體來看,目前公司正在進行CS1001(PD-L1)的總計6項註冊性試驗。其中,公司正在向國家藥品評審中心(CDE)諮詢cHL及NKTL的註冊策略,預計於2020年下半年提交cHL適應症在中國大陸的新藥申請,並可能於2020年下半年提交NKTL適應症在中國大陸的新藥申請。
根據公開資料顯示,中國PD-1/PD-L1的市場預測將達到50-100億美元。其中,CS1001針對目前公佈的適應症銷售峯值將達到5億美元,主要來自於大適應症非小細胞肺癌、胃癌以及食管癌。而公司的研發管線中,該產品在其他適應症的應用有望進一步提升產品的銷售峯值。
CS1003(PD-1) 與CS1002(CTLA-4)其他兩大骨幹藥物
CS1003是人源化的IgG4亞型的抗PD-1單抗,具有同時識別人和小鼠PD-1的獨特優勢。根據中國I期橋接臨牀數據顯示(2019年CSCO年會中公佈),CS1003(PD-1)單藥具有良好的安全性和耐受性,且在多種腫瘤類型中均觀察到了抗腫瘤活性。
目前,公司已啟動多項聯合治療的臨牀試驗研究,包括:2019年12月CS1003(PD-1)聯合拜耳公司的樂伐替尼(lenvatinib)療法的全球III期試驗,樂伐替尼為用於晚期肝細胞癌(HCC)患者的標準酪氨酸激酶抑制劑(TKI);2019年12月在澳洲進行CS1003(PD-1)聯合瑞戈非尼的臨牀Ib期試驗實現首例患者給藥等。
CS1002是全長全人源IgG1亞型的抗CTLA-4單抗,根據2019年CSCO公佈的數據顯示,CS1002(CTLA-4)治療耐受性良好,有可能成為繼Ipilimumab(中國未上市)之後,下一個療效突出的CTLA-4抑制劑。CS1002(CTLA-4)在2019年12月完成臨牀I期首次患者給藥,並在2020年1月在澳洲進行與CS1003(PD-1)聯合治療實體瘤換成的臨牀I期試驗劑量遞增部分中實現首例患者給藥,使得公司在這一聯合治療方案中處於領先地位。
產品管線2.0:更加先進的產品組合
作為國內唯一一家同時擁有臨牀階段PD-1、PD-L1以及CTLA-4產品的公司,基石藥業並不滿足於停留在三大靶點上,而是不斷探索尋找,是否存在下一個類似於PD-1/PD-L1這樣市場空間大、治療療效好的產品,這也就是基石藥業研發創新的新方向,也就是2.0產品管線的核心思想。
如何打造更加先進的產品組合?按照公司披露的計劃,公司將在原有的免疫腫瘤骨幹藥物和資產的基礎上,尋找同類首創或者同類最優的多重特異性單抗/分子骨架,或者最大化PD-(L)1療效的腫瘤微環境調節劑,未來也有可能尋找癌症疫苗,或者新的通路抑制劑。
具體操作上,對外引進優質資產,與國內外領先的生物醫藥公司合作,獲得獨家開發和商業化權益,對內展開重點臨牀開發,以腫瘤免疫聯合療法作為重點臨牀合作項目。
TIBSOVO®(Ivosidenib):同類首創,在美國獲批上市,已在中國台灣提交新藥申請
TIBSOVO®(ivosidenib)是全球同類首創IDH1抑制劑,已經獲得美國FDA批准治療伴有IDH1突變的急性髓系白血病(IDH1m AML)。基石藥業已在2018年6月獲得Agios獨家許可,可以在中國地區(包括港澳台)對TIBSOVO®(Ivosidenib)進行臨牀開發及商業化開發。
2019年5月, TIBSOVO®(ivosidenib)的新藥申請已提交台灣食品藥物管理署(TFDA),用於治療含有IDH1突變的復發難治性急性髓系白血病(IDH1m R/R AML),預計將於2020年獲得市場批准。IDH1m AML的兩項註冊性試驗正在中國進行:一項IDH1m R/R AML的註冊性試驗預計於2020年完成試驗,並於2021年上半年在中國提交新藥申請;另一項試驗針對不符合強化治療條件的新診斷的IDH1m AML患者。
AYVAKITTM(avapritinib):同類首創, 在美國獲批上市,已向中國台灣提交新藥申請
Blueprint 研發的AYVAKITTM(avapritinib)是全球同類首創PDGFRA/KIT抑制劑,首個獲得美國FDA批准的胃腸道間質瘤(GIST)精準療法,也是PDGFRA外顯子18突變體(包括D842V突變)GIST的唯一高活性療法。
基石藥業作為擁有AYVAKITTM(avapritinib)在中國地區(包括港澳台)獨家開發及商業化許可的公司,目前已經在台灣針對用於治療PDGFRA外顯子18 突變(包括PDGFRAD842V突變)不可切除或轉移性GIST適應症提交新藥申請。
此外,公司在中國針對無法切除或轉移性GIST的患者已啟動AYVAKITTM(avapritinib)的兩項註冊性試驗。一項試驗是中國藥代動力學橋接研究,用於治療PDGFRA外顯子18 突變的晚期GIST,預計於2020年上半年將在中國提交新藥申請。另一項試驗在三線GIST中進行,作為一項比較AYVAKITTM(avapritinib)和瑞戈非尼全球III期試驗的一部分。該研究已經完成招募,預計於2020年第二季度將獲得全球臨牀試驗關鍵數據,並於2020年下半年於中國提交新藥申請。
Pralsetinib(RET):潛在同類首創,已啟動美國FDA新藥上市滾動申請
Pralsetinib是首個針對RET突變非小細胞肺癌的潛在同類首創RET抑制劑,目前已經啟動美國FDA新藥上市滾動申請。
作為擁有pralsetinib中國地區(包括港澳台)獨家開發及商業化許可的公司,基石研究pralsetinib 用於治療RET突變的NSCLC、甲狀腺髓樣癌(MTC)和其他晚期實體瘤。目前已經完成了在中國的RET融合陽性NSCLC適應症二線治療隊列研究的招募,並預期於2020年下半年在中國針對此適應症提交新藥申請。此外,基石已啟動一線RET融合陽性NSCLC的其他註冊隊列,預計於2020年上半年實現首例受試者給藥。
強化基石腫瘤管線,賦能聯合療法開發
今年,基石藥業新增了與兩家知名藥企的合作。2019年6月,基石藥業與拜耳達成以中國為重點的全球臨牀合作關係,評估PD-L1藥物CS1001聯合拜耳的口服多激酶抑制劑瑞戈非尼在治療包括胃癌在內的多種癌症時的安全性,耐受性,藥代動力學特徵以及抗腫瘤活性等在內關鍵數據,這也是雙方合作開展的首個全球概念驗證性研究。
此外,2019年5月基石藥業與瑞士Numab Therapeutics AG達成區域性獨家協議,主要針對NM21-1480的開發和商業化。NM21-1480是一種針對PD-L1,4-1BB和人血清蛋白的單價三特異性抗體片段分子。此次基石藥業獲得NM21-1480的開發和商業化,不僅能夠在未來商業化中,獲得大中華區,韓國以及新加坡獨家開發和商業化NM21-1480的權利,還能夠間接獲得Numab獨創的多特異性抗體技術平台的使用。
2020年:商業化加速,產品進入收穫期
2019年,公司在研發產品上獲得了多項重大進展。截至目前,已有兩款新藥在台灣提交上市申請。2020年,公司預計一款新藥上市申請獲批,另有多款新藥計劃提交上市申請。由此,公司商業化進程正積極推進,並將為公司提供可預見的現金流。
具體來看,公司將會有TIBSOVO®(Ivosidenib)在中國台灣提交新藥上市申請預計在2020年獲得批准並上市。此外,公司預計2020年將會有CS1001(PD-L1)、AYVAKITTM(avapritinib)、pralsetinib(RET)三款藥物提交新藥上市申請,臨牀試驗共計擁有30項,其中包括15項註冊性試驗。
圖表四:2020年重大事件計劃表
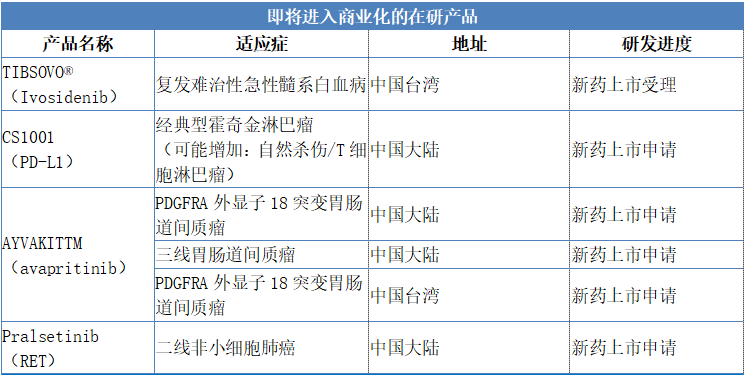

數據來源:公司公告,格隆彙整理
為了配合接下來一系列產品的商業化,公司聘請了前BMS中國大陸及香港地區總經理趙萍女士擔任大中華區總經理及公司商業化負責人,並計劃在2020年底前將商業化團隊規模擴大至200人,並在2021年前進一步提升至400人。
與此同時,公司為生物製劑及小分子配備強大的生產能力,目前已與新建元(蘇州工業園區所屬企業)簽訂協議建設生產基地,規劃總計容面積近100,000㎡,預計產能達到26,000L大分子生物藥和10億片小分子化學藥片劑和膠囊。該基地預計將於2020年上半年動工興建。
小結
2019年初,基石藥業成功在港交所上市。而僅僅一年左右的時間,公司就有兩款創新藥提交新藥申請,意味着公司正在加速向商業化進程推進轉型。這一進程也獲得了資本市場的積極關注。目前,公司取得了5家頂級金融機構的推薦,包括高盛、摩根士丹利、摩根大通、瑞銀與招商證券(香港)。
正如產品需要更新換代來跟上時代的發展,觀察公司的發展路徑可以發現,公司也在通過升級產品管線來豐富與應對日益擴大的腫瘤市場。更加強大的產品管線2.0,配合不斷升級完善的商業化能力,變身成為“現金牛”指日可待。




