昨夜,美國股市經歷了自1987年10月以來最慘的一夜,道瓊斯指數收跌接近3000點,跌幅接近13%,創三年以來新低。然而,Blueprint Medcines在美股開盤遭遇熔斷之際,卻因公佈關於avapritinib作用於惰性系統性肥大細胞增多症(SM)重要臨牀數據以及成為首個獲得美國FDA批准的胃腸道間質瘤(GIST)精準療法,逆勢上漲,盤中最高漲幅達到19%。
圖表一:Blueprint股價走勢圖
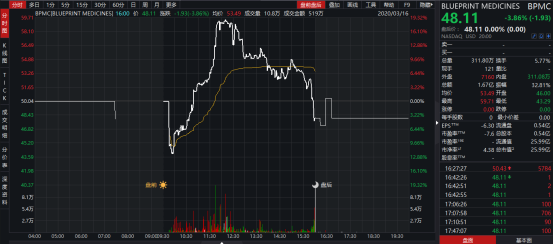
數據來源:WIND,格隆彙整理 數據為2020年3月16日當日走勢圖
作為擁有avapritinib中國獨家許可權的基石藥業-B(2616.HK),近段時間頻出研發喜訊,一則是全球首款胃腸道間質瘤精準靶向藥AYVAKITTM美國獲批上市,另一則消息則是pralsetinib主要臨牀試驗數據,已啟動美國FDA新藥上市滾動申請。此外,2020年基石藥業成功在美國紐約舉辦研發論壇,並與國內外頂尖學者與專家共同探討了中國腫瘤治療領域變革發展的新趨勢。
值得注意的是,伴隨着公司腫瘤藥物獲批上市,公司也在進一步完成“管線2.0”的創新升級,並向成熟的創新平台與商業化階段轉型,並在未來2-3年內將新藥適應症申請擴大至近10個品種。

全球首款胃腸道間質瘤精準靶向藥美國獲批上市
3月16日,基石藥業的合作伙伴Blueprint 公佈,avapritinib在作用於惰性系統性肥大細胞增多症(SM)的臨牀試驗PIONEER帶來了好消息。
根據avapritinib在PIONEER 臨牀II期試驗中的最新結果顯示,avapritinib用於惰性系統性肥大細胞增多症(SM)患者與安慰劑相比具有顯著的臨牀改善,具有良好的耐受性,沒有患者因不良事件(AE)中斷治療。
具體來看,在PIONEER試驗的第1部分中,用惰性SM症狀評估表(ISM-SAF)進行了測量,接受avapritinib治療的患者在16周時的總症狀評分(TSS)平均下降了約30%,具有統計學意義,且症狀評分降低的程度隨着時間的推移而加深。此外,用avapritinib治療的患者在客觀指標方面,包括肥大細胞負荷及患者報告的生活質量均取得了持續的改善。根據第1部分的完整數據,患者已選擇25毫克每天一次(QD)作為臨牀II期試驗的推薦劑量(RP2D)。這部分數據將會在美國過敏學會、哮喘和免疫學(AAAAI)虛擬論壇上展示。
值得注意的是,Blueprint 研發的AYVAKITTM(avapritinib)此前已經成為首個獲得美國FDA批准的胃腸道間質瘤(GIST)精準療法,也是PDGFRA外顯子18突變體(包括D842V突變)GIST的唯一高活性療法。
胃腸道間質瘤(GIST)是一種罕見的由基因組驅動的胃腸道腫瘤,是最常見的消化道間葉性腫瘤。
然而在GIST患者中,大約有6%的患者具有血小板衍生的生長因子受體α(PDGFRA)外顯子18突變,主要為D842V位點突變,這部分患者無法通過現有治療方式進行治療,並對已有藥物產生抗藥性,一項回顧性研究數據顯示,患者接受伊馬替尼治療時,緩釋率(ORR)為0%。
FDA根據全球多中心I期NAVIGATOR臨牀試驗的數據,以及avapritinib多項臨牀試驗的綜合安全性結果,授予了AYVAKITTM完全批准。Blueprint 公司已計劃在一週內將Ayvakit推向美國市場。
在PDGFRA基因18號外顯子突變的GIST患者中,Ayvakit治療的臨牀數據顯示:
客觀緩解率(ORR):86%(95%CI:69%,93%),且中位緩解持續時間(DOR)尚未達到。
不良反應: 20%以上患者中常見的為1-2級的水腫、噁心、疲勞/乏力、貧血、認知影響、嘔吐、食慾下降、腹瀉、髮色改變、流淚增多等。
在宣佈FDA批准Ayvakit的同時,Blueprint 公司還宣佈,FDA已將最初提交的新藥申請(NDA)中avapritinib擬議的適應症分為了2個單獨的NDA:一個是FDA此次批准的PDGFRA外顯子18突變GIST,另一個是四線GIST標準治療。
四線GIST適應症的處方藥用户收費法(PDUFA)目標日期為2020年2月14日。如前所述,對於四線GIST的NDA,可能需要將PDUFA目標日期延長3個月,以便Blueprint 公司向 FDA提交III期VOYAGER研究的關鍵數據,該研究正在評估avapritinib與瑞戈非尼(regorafenib)在三線或四線GIST的療效。2019年ASCO年會上公佈的數據透露,avapritinib治療四線GIST的總緩解率(ORR)為22%,中位緩解持續時間(DOR)達到10.2個月。
總體而言,在avapritinib藥品用於治療GIST上公司在2020年的預計研發計劃為:
圖表二:2020年關於avapritinib的研發計劃表
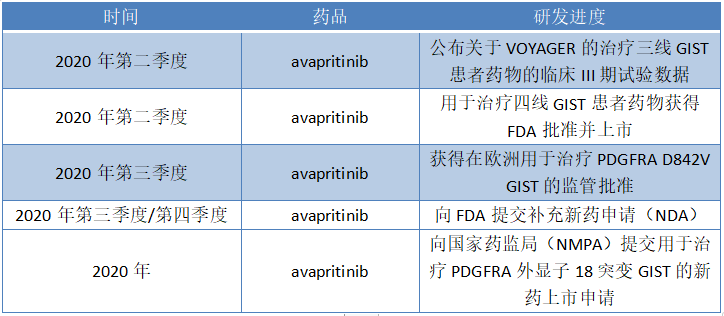
數據來源:公司公告,格隆彙整理
從市場空間上來看,基石藥業已經擁有關於avapritinib的中國獨家許可權。根據Frost&Sullivan數據統計顯示,中國胃腸道間質瘤的發病人數已經由2013年的2.62萬例增加至2017年的3萬例,複合年增長率為3.4%,預計2030年將增長至4.33萬例。
圖表三:中國市場胃腸道間質瘤(GIST)的發病人數
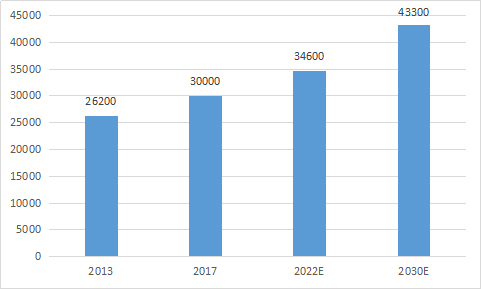
數據來源:Frost&Sullivan,格隆彙整理
另一款抗癌藥也在獲批路上
2020年1月8日,基石藥業的合作伙伴Blueprint Medicines公佈了pralsetinib 關於治療RET融合非小細胞肺癌(NSCLC)的主要臨牀數據,並已啟動美國FDA新藥上市滾動申請。
Pralsetinib是一種口服(每日一次)、高效和高選擇性的靶向致癌性RET變異的在研藥物。與目前市面上的多激酶抑制劑不同,pralsetinib能夠有效的與RET特異性結合,從而可以選定指定靶點並且使得脱靶毒性降至最低。
此前,美國FDA已經授予pralsetinib突破性療法認定,用於治療經含鉑化療進展的RET融合非小細胞肺癌、和需要系統治療且沒有可替代治療方案的RET突變甲狀腺髓樣癌患者的治療。
此次公佈的臨牀I/II期ARROW研究數據顯示:
對於80例既往接受過含鉑化療治療的RET融合NSCLC患者,客觀緩釋率ORR為61%(95%CI:50-72%),其中95%患者觀察到患者中觀察到了影像學腫瘤縮小,其中14%患者達到目標腫瘤的完全緩解。至數據截止,中位DOR尚未達到。
對於26例初次治療RET融合NSCLC患者,總緩釋率ORR為73%(95% CI:52-88%),其中12%的受試患者達到完全緩解,100%患者中觀察到影像學腫瘤縮小。
根據Blueprint官網顯示,在pralsetinib藥品研發上公司2020年預計將實現以下目標:
圖表四:2020年pralsetinib的研發計劃表
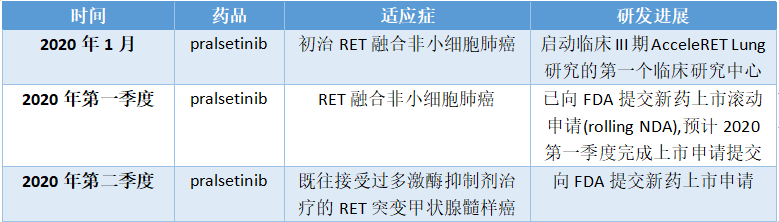
數據來源:公司公告,格隆彙整理
從市場空間上來看,基石藥業已經擁有關於pralsetinib的大中華地區獨家許可權。根據Frost&Sullivan數據統計顯示,pralsetinib用於兩種適應症中,在非小細胞肺癌上,中國患病人數龐大,2013年為64.05萬人,預計在2030年將達到約107萬人。而在甲狀腺髓樣癌上,患病人數增長迅猛,2013年患病人數為4200人,到了2017年則達到9100人,複合年增長率為21%,預計到2030年複合年增長率將放緩至11.3%,2030年患病人數達到3.67萬人。
圖表五:中國非小細胞肺癌NSCLC(左)與甲狀腺髓樣癌MTC(右)患病人數

數據來源:Frost&Sullivan,格隆彙整理
小結
基石藥業在上市之初,就以抗腫瘤藥物配合腫瘤免疫(IO)聯合療法為其核心的產品管線著稱,也有望成為腫瘤領域聯合療法生物科技公司的代表企業。
此次公佈的兩款藥物的研發進展,都是從Blueprint手中拿下大中華地區獨家開發和商業化許可的抗腫瘤領域的優質藥物。
Avapritinib早前就成為治療GIST和SM的孤兒藥,並且已經獲得FDA的突破性治療認定。此次獲得美國FDA批准上市,成為全球首款胃腸道間質瘤精準靶向藥,這將打開全球市場格局,併為未來基石藥業在大中華地區銷售打下紮實的基礎。
另一款用於治療NSCLC和MTC的pralsetinib,此前也被FDA定義為用於治療RET改變的NSCLC患者的罕用藥以及用於治療RET突變陽性MTC的突破性療法認定。此次提交FDA滾動上市申請,也為腫瘤領域中大適應症非小細胞肺癌患者帶來福音。
總體而言,面對基數龐大但仍不斷增長的腫瘤領域,傳統治療方式已經開始轉變為更加先進科學的靶向以及腫瘤免疫療法。從支付端來看,能夠支付癌症治療費用的人羣在不斷擴大。從政策上來看,醫改政策頻發,創新藥也正逐步納入醫保範圍內,藥品售價逐漸趨於平民化,這將為中國的抗腫瘤藥物帶來新的機遇與挑戰。擁有平價而療效好的藥品,方能成為行業贏家。而在這方面,基石藥業的兩款藥療效好,全球首發獲批上市以及在獲批上市路上,第一個吃螃蟹的人,值得期待。




