最新上市的生物製藥企業復宏漢霖-B(2696.HK)綠鞋期於10月17日結束,完成超額配股發行436.64萬股,約佔全球發售初步認購股份數額的6.75%,淨籌2.1億港元。從研發方向來看,復宏漢霖選擇從生物類似藥開發着手進行商業化,並延伸到創新藥研發,聯合治療,這種方式能否把握當前政策趨勢,在大破大立之際突出重圍?
中國醫藥企業迎來新機遇與挑戰
根據麥肯錫數據顯示,相較於2015年,2018年中國醫藥創新生態系統在政策環境,資金投入,人才隊伍,本土創新,國際接軌等方面都有不同程度提升。整體而言,中國醫藥企業在各方面正迎來新的機遇與挑戰。
從資金投入上來看,港交所的改制以及內地的科創板,都正在成為生物科技類企業以及投資者新的融資渠道和退出選項。從人才隊伍上來看,隨着本土創新藥企的崛起,創新人才近年來呈現出從跨國企業向本土企業流動的整體趨勢,如何更好的提升人才隊伍質量,實現本土作戰的角色轉變將是中國藥企將要面臨的挑戰。
從政策環境上來看,中國藥企也正擁有着前所未有的機遇。對於生物類似藥而言,藥監局對其監管正不斷完善,促進生物類似藥行業健康發展。2015年MPA藥品審批中心(CDE)首次頒佈針對生物類似藥政策,對生物類似藥申報程序,註冊類別和申報資料等相關要求進行規範,並於2017年規範生物類似藥通用名,保證臨牀使用和流通過程中對生物製品的準確識別,進一步為生物類似藥向國際化接軌鋪平道路。
另一方面,藥監局也在不斷完善創新藥有關審批流程,意在逐漸帶動中國藥品審評與全球實踐和標準接軌。2015年前新藥臨牀試驗申請獲批所需時間約為兩年甚至更久,而到2018年底已經降至8-10個月,全面落實備案制後,有望進一步縮短至60個工作日,優先審評審批,有條件獲批以及接受海外臨牀數據等政策的出台,均加速了新藥的臨牀試驗和獲批進程。
圖表一:2015年至2018年藥監局改革取得的重大成就
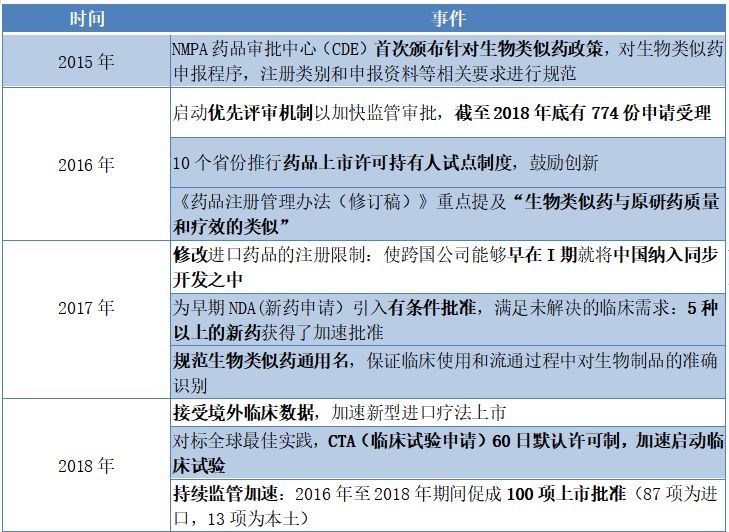
數據來源:CFDA/NMPA,格隆彙整理
復宏漢霖:“仿創結合”典型藥企
在醫藥政策不斷出台下,新晉藥企的發展路徑也開始有所不同。復宏漢霖就是“仿創結合”典型企業,從生物類似藥起步,逐步開發創新型單抗產品,結合自主開發的抗PD-1和PD-L1單抗,在國內率先推出免疫聯合療法,前瞻性佈局了一個多元化、創新單抗及腫瘤免疫聯合療法管線,打造出研究、開發、商業化生產的綜合性生物醫藥全產業鏈平台。
早在十年前,復宏漢霖研發團隊就關注到了生物類似藥領域。生物類似藥,是生物界的“仿製藥”,與合成的小分子化學藥相比,生物藥的分子結構藥遠比化學藥複雜,仿製難度遠高於化學仿製藥,擁有更高的護城河。
根據IMS統計數據顯示,首個生物類似藥上市後平均5年佔市場份額(包括原研藥和所有生物類似藥)超過40%。以較早起步的歐洲生物類似藥市場為例,在生物類似藥獲批商業化後的5年內,替代曲線不斷上升,最終在整個市場上達到約44.1%的市場份額,佔據半壁江山。
而擁有國內首款商業化生物類似藥的復宏漢霖,在產品管線上,繼漢利康®走向商業化後,其他生物類似藥也在快速推進,包括(i)中國首個開展國際多中心(包括中國,波蘭,烏克蘭,菲律賓)臨牀3期試驗的生物類似藥HLX02(注射用曲妥珠單抗),有望成為首個在歐盟上市的中國開發的單抗生物類似藥;(ii)HLX03(阿達木單抗注射液)已在中國完成臨牀3期試驗,2019年1月獲得NMPA的NDA申請受理,目前處於優先評審中;(iii)HLX04(貝伐珠單抗生物類似藥)於2018年第二季度已經進入臨牀3期試驗階段等。
圖表二:產品管線
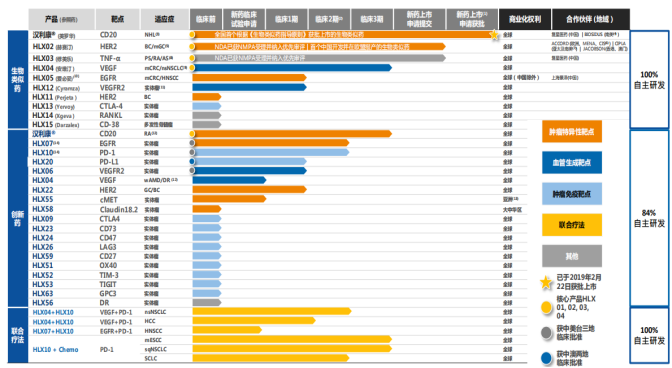
數據來源:公開資料,格隆彙整理
伴隨着多項生物類似藥逐步上市,將為復宏漢霖未來發展提供穩定的現金流,在未來發展戰略上,公司將繼續踐行仿創結合模式,進一步豐富產品組合,並積極佈局聯合療法,抓住未來增長機遇。
根據公司公告顯示,目前在研的生物創新藥包括HLX06(抗VEGFR2單抗)、HLX07(抗EGFR單抗)、HLX10(抗PD-1單抗)、HLX20(抗PD-L1單抗)以及HLX22(抗HER2單抗)等皆在全球範圍啟動1期/2期臨牀試驗。
值得注意的是,2019年10月17日,公司的創新產品HLX55(抗c-MET單抗)獲得國家藥監局臨牀試驗批准,未來可用於轉移性或複發性實體瘤的治療。據悉,國內外尚未有同類藥物上市銷售,HLX55上市後有望為醫生提供更多治療選擇,惠及更多腫瘤患者。
差異化戰略模式:“聯合治療+全球化策略”
雖然PD-1/DP-L1賽道中已經擁有多家公司進行競爭,但在治療效果上還是存在巨大差異。
實際上,針對大部分實體瘤,單獨使用PD-1/PD-L1抗體的有效率僅有20%,遠低於預期使用效果。如何將藥物發揮最大的作用,目前最高效的解決方案便是聯合治療。聯合治療是一種綜合解決方案,是將放療,化療以及靶向治療三種治療方式結合起來進行配合治療。聯合療法通過多種治療方式的結合,減少單一治療方式帶來的弊端,讓藥物效果發揮更大作用。
採用腫瘤免疫聯合療法,使得藥物的治療範圍更廣,療效更佳,這也是復宏漢霖在腫瘤免疫聯合療法差異化戰略所在,採用“聯合治療+全球化策略”。目前,公司已陸續就HLX10(抗PD-1單抗)與自有產品HLX04等單抗以及化療聯用開展多項實體瘤的臨牀研究。
圖表三:免疫聯合療法
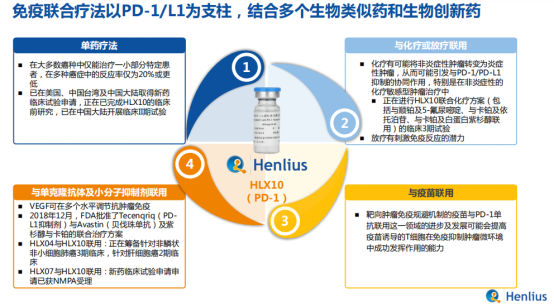
數據來源:公開資料,格隆彙整理
在全球商業化進程上,日前公司已與KG Bio簽訂正式合約,授予KG Bio其自主研發產品HLX10(重組抗PD-1人源化單克隆抗體注射液)用於相關療法和適應症的獨家開發和商業化權利,具體包括其首個用於治療高度微衞星不穩定型實體瘤的單藥療法、兩項聯合療法及KG Bio可根據《條約》選擇引進的兩項新適應症。授權地區覆蓋東南亞10個國家,預計總計金額可達6.92億美元。根據公開資料顯示,KG Bio(Kalbe Genexine Biologics)是由東南亞規模最大的上市醫藥公司之一Kalbe Farma同韓國頂尖生物技術研發公司Genexine 合資組建,此次復宏漢霖與其簽訂商業化的開發協議,將加速復宏漢霖腫瘤免疫聯合療法戰略在東南亞地區的進一步落地。
小結
在諸多未盈利生物製藥企業中,有直接衝着全球首例的,也有仿創結合的,從投資的角度來説,回報週期長短不同。以復宏漢霖為例,在上市前已經完成核心生物類似藥的商業化進程,比起其他產品還在臨牀前期的企業而言,擁有更好的財務狀況,投資回報也更加快速。對於其公司發展戰略而言,下一步就是做好幾項臨近商業化產品的進程,並不斷推進正在研發的創新類產品,並在治療方式上進行差異化發展。雖路有荊棘,但仍能迎接機遇,未來可期。




