本文來自格隆匯專欄:醫藥魔方
根據醫藥魔方PharmaGo數據庫統計的結果,2021年國家藥品監督管理局(NMPA)共批准83款新藥,其中國產新藥51款,進口新藥32款;從藥物類型上看,包括38款化藥、33款生物藥(涵蓋抗體、重組蛋白、ADC、疫苗、細胞療法、變態反應原製品)、12款中藥。
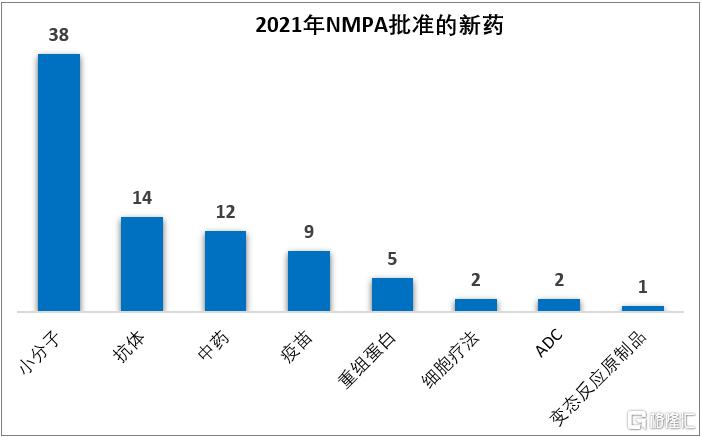
注:新藥定義為NMPA首次批准的活性成分、中藥、疫苗、細胞療法,不包括新適應症、新劑型、生物類似藥。若複方中包含的活性成分非首次批准,不納入統計。數據來源:醫藥魔方PharmaGo
2021年批准的新藥數量創下了自2016年藥品審評審批改革以來的新高,尤其是中藥新藥在沉寂數年之後迎來了大爆發,2021年批准了12款中藥,相比之下,NMPA之前2016-2020這5年累計批准的中藥新藥是14款。
從疾病領域來看,2021年NMPA批准的新藥仍以腫瘤藥居多,佔比31%(26/83);其他佔比較高的疾病領域還包括感染性疾病(28%,23/83)、內分泌代謝(12%,10/83)、神經精神(11%,9/83)、血液6%(5/83)。

2021年NMPA批准的83個新藥中,有49個是以“優先審評”的方式獲批,佔比59%,化藥、生物藥、中藥均有涉及;此外,NMPA在2021年批准了12個罕見病藥物(均為進口藥),13個臨牀急需用藥。
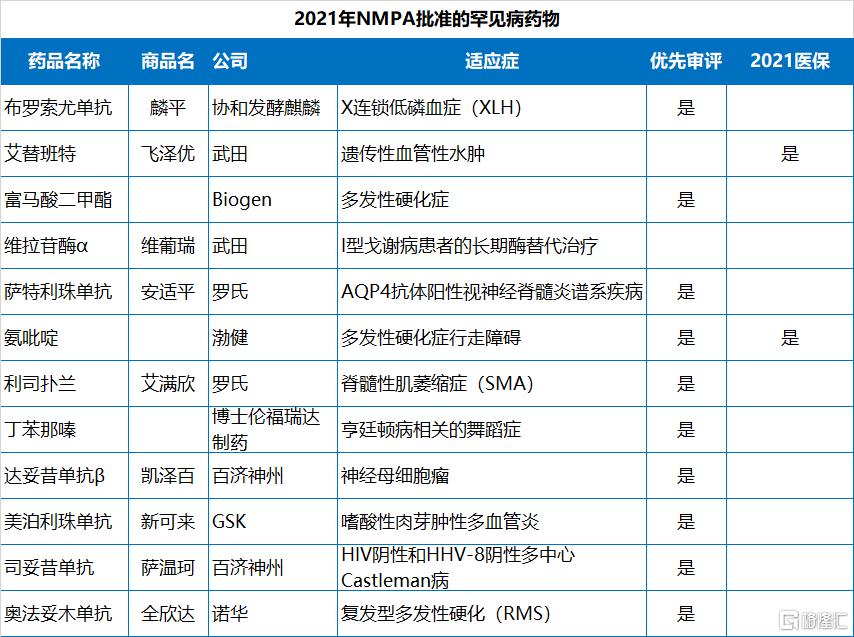
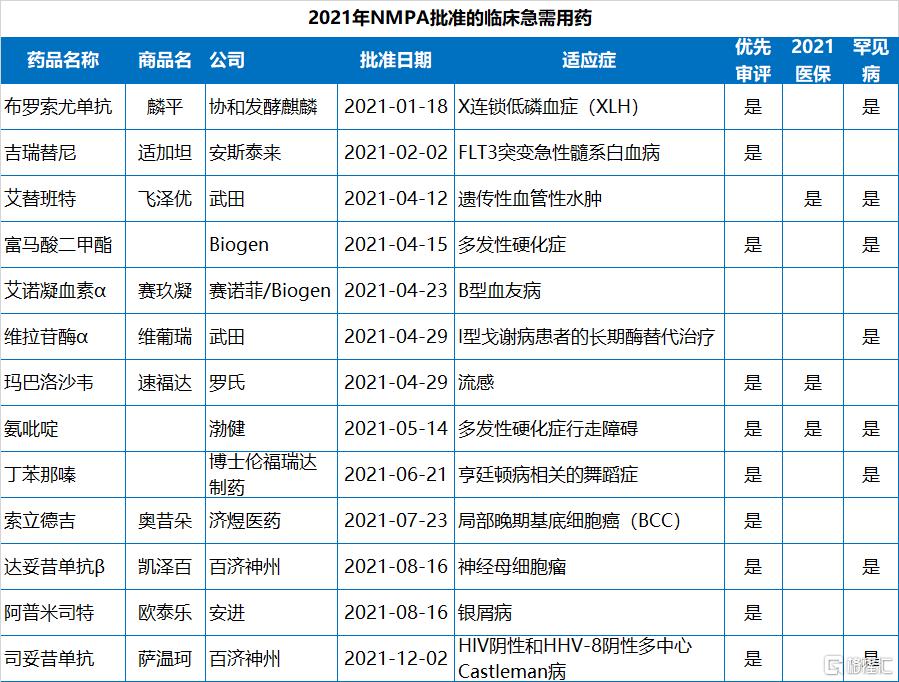
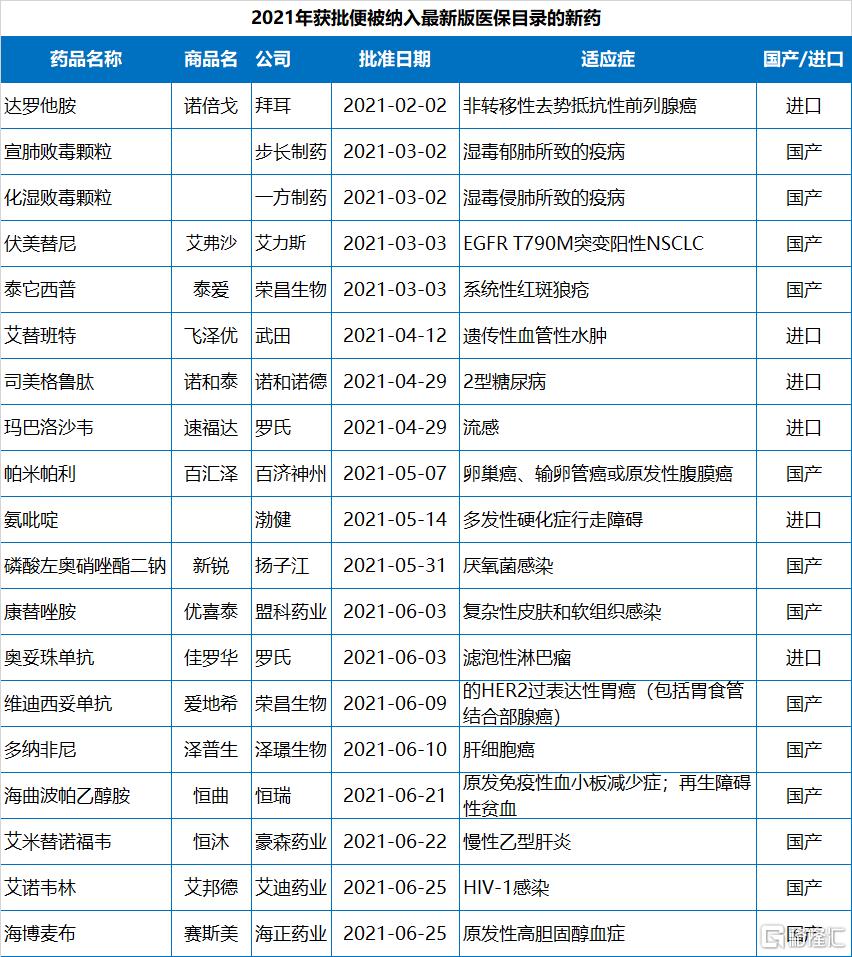
值得指出的是,2021年NMPA批准的83款新藥中,已經有19款通過醫保談判納入了2021年國家醫保目錄,包括13款國產新藥和6款進口新藥。協議有效期為2022年1月1日—2023年12月31日。
2021年NMPA批准的83個新藥中,有10款曾被CDE納入突破性療法,有10款屬於First in class新藥。有17款新藥是附條件批准上市。
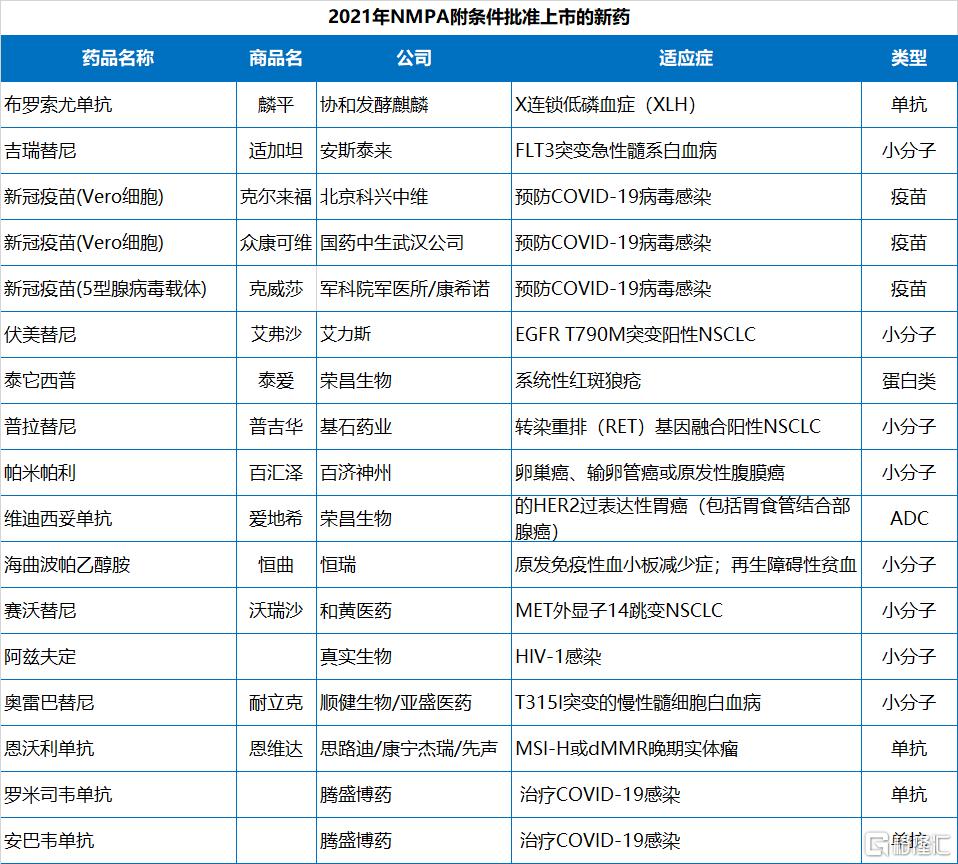
第二梯隊國產PD-1/PD-L1陸續獲批
以PD-1/PD-L1為代表的免疫檢查點抑制劑的上市顯著改善了癌症患者的生存結局和生活質量。然而,PD-1/PD-L1藥物的巨大商業前景也引發了me too藥物的扎堆研發,造成同質化競爭嚴重。
今年,NMPA共批准了4款PD-1/PD-L1,且全都由本土企業開發。分別來自正大天晴/康方生物、譽衡生物、思路迪/康寧傑瑞/先聲藥業、基石藥業。截止目前,國內已有12款PD-1/PD-L1藥物上市。
2021年NMPA批准的PD-1/PD-L1藥物
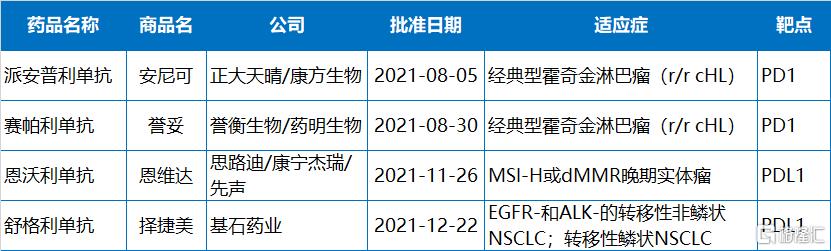
多家本土企業迎來首個商業化產品
隨着醫藥改革,國家政策和資本對創新藥開發的支持,我國多款本土創新藥迎來收穫期,且多款藥品都是企業的首個商業化產品。
艾力斯醫藥開發的三代EGFR-TKI伏美替尼、澤璟生物開發的首個國產肝癌一線靶向藥多納非尼、德琪醫藥選擇性核輸出蛋白(SINE)抑制劑塞利尼索、真實生物開發的首個雙靶點抗HIV-1藥物阿茲夫定、盟科藥業歷經十二年開發的新一代噁唑烷酮類抗菌藥康替唑胺、亞盛醫藥的三代BCR-ABL TKI奧雷巴替尼、騰盛博藥/清華大學/深圳市第三人民醫院聯合開發的新冠中和抗體雞尾酒療法安巴韋單抗/羅米司韋單抗、譽衡生物開發的抗PD-1抗體賽帕利單抗、華昊中天埃博黴素類抗癌藥優替德隆等均為這些公司首款獲批新藥。
此外,還有部分本土企業在今年獲批了不止一款新藥,例如恆瑞,今年連批3款新藥。在2021年的最後一天迎來了公司的第9、10款新藥CDK4/6抑制劑達爾西利和SGLT-2抑制劑恆格列淨,該公司今年6月份獲批的新藥海曲波帕乙醇胺片也順利被納入最新版(2021版)醫保目錄。
NMPA加速批准新冠藥物
具離新冠疫情爆發已過去兩年時間,但人類仍在與新冠病毒做着頑強鬥爭。在中國,科學家和監管機構也在努力將新冠治療和預防藥物遞送到人民手中。今年,國家藥監局附條件批准了3款新冠疫苗和1款新冠中和抗體,3款疫苗分別來自北京科興中維、國藥中生武漢公司、軍科院軍醫所/康希諾。新冠中和抗體則來自騰盛博藥/清華大學/深圳市第三人民醫院。

首款國產ADC獲批
6月9日,國家藥品監督管理局(NMPA)附條件批准榮昌生物自研注射用維迪西妥單抗(Disitamab Vedotin,商品名:愛地希®)上市,適用於至少接受過2種系統化療的HER2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療。這意味着中國迎來了首個國產ADC藥物,維迪西妥單抗成為榮昌生物繼系統性紅斑狼瘡新藥泰它西普之後第2個進入商業化階段的新藥。
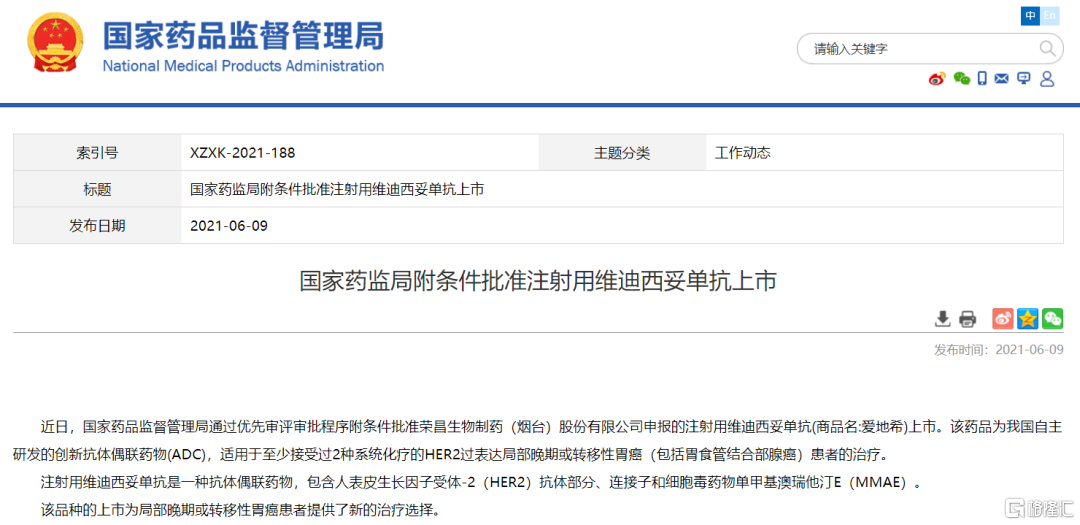
維迪西妥單抗是榮昌生物自主研發的靶向人表皮生長因子受體2(HER2)的ADC,用全新的、親和力更強、內吞效果更好的人源化抗體迪西妥單抗、可裂解的連接子、微管單體蛋白聚合抑制劑MMAE(單甲基澳瑞他汀E)組成。抗體迪西妥單抗與腫瘤細胞表面的HER2抗原結合,整個藥物被內吞進入細胞,連接子經酶切斷裂,釋放MMAE,殺傷腫瘤細胞。
除了維迪西妥單抗,榮昌生物開發的另外2款ADC候選藥物RC88(間皮素ADC)和RC108(c-Met ADC)已處於I期臨牀開發階段。
里程碑:中國迎來首個CAR-T療法
6月22日,復星凱特靶向CD19自體嵌合抗原受體(CAR)T細胞療法阿基侖賽注射液(axicabtagene ciloleucel)在中國的上市申請獲得NMPA批准,這是國內首個獲批上市的CAR-T療法。
阿基侖賽注射液是吉利德/Kite製藥開發的靶向CD19的基因修飾自體CAR-T細胞注射液。2017年10月,阿基侖賽注射液獲得FDA批准上市(商品名:Yescarta),是FDA批准的第2款CAR-T療法,是首款針對非霍奇金淋巴瘤的CAR-T療法。
復星凱特於2017年初從美國KitePharma引進Yescarta,獲得全部技術授權,並擁有其在中國包括香港、澳門的商業化權利,並於中國境內(不包括港澳台)進行本地化生產。
目前全球已有6款CAR-T療法獲批上市,5款靶向CD19,1款靶向BCMA,分別是諾華的Kymriah(2017年8月獲批),吉利德的Yescarta和Tecartus(2017年10月、2020年7月獲批),百時美施貴寶的Breyanzi 和Abecma(2021年2月、2021年3月獲批),藥明巨諾的Relma-cel(2021年9月獲批)。目前國內共有兩款CAR-T療法獲批。
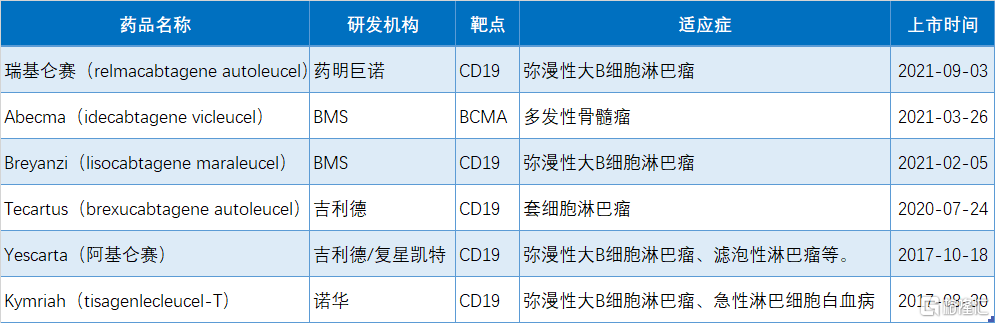
附表:2021年NMPA批准的新藥





