生存是文明的第一需要,這是劉慈欣在《三體》中提出的觀點,而新世紀以來讓人類深刻意識到這句話的意義的,是目前依舊在全球範圍傳播的新冠疫情。當然人類也證明了文明的堅韌,憑藉着疫苗、治療藥物、隔離措施以及各種防治措施,在與病毒抗爭了近兩年後,終於在部分區域取得優勢。
就在12月9日,首款中國企業自主研發的新冠中和抗體(安巴韋單抗/羅米司韋單抗)BLA成功獲批上市。這意味着,作為目前全球範圍內防疫工作最傑出的國家,中國正式擁有了自研的對抗新冠的中和抗體藥物。在疫情常態化的趨勢下,面對疫情的防治,我們又多了一個強有力的武器。
一如過往在抗疫過程展現的中國速度,此次中和抗體的研發同樣速度驚人,該藥物從立項到如今獲批上市,僅僅用了20個月,這對於動輒需要5-10年的創新藥研發而言,其速度堪稱“火箭式爆發”,中國速度彰顯無疑。
國產首個BLA獲批新冠中和抗體彰顯中國速度
新冠疫情剛剛爆發,作為傳染病領域領軍者的騰盛博藥,迅速與清華大學和深圳市第三人民醫院共同成立騰盛華創,隨後憑藉着合作各方強大的研發能力,成功從新冠恢復期患者血清中分離獲得非競爭性新冠病毒中和抗體。
隨後,在不到6個月時間內完成了從選定先導藥物到在人體中進行首劑用藥的臨牀試驗。並於2020年10月納入了ACTIV-2和ACTIV-3項目。隨後,憑藉着優秀的臨牀表現,其臨牀試驗進度迅速推進。
圖表一:新冠中和抗體近期進展
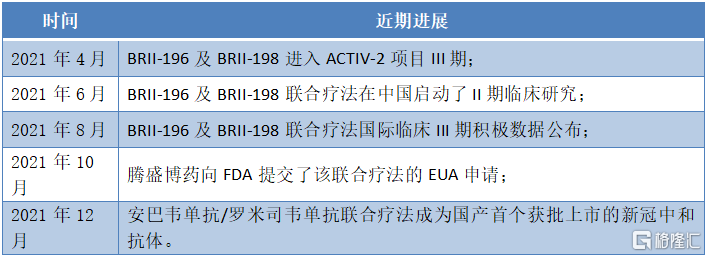
資料來源:公司公吿,格隆彙整理
僅用1年多時間,就完成了從立項到獲批上市的全流程,研發速度大幅領先同類產品。
安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)聯合療法不僅擁有“中國速度”,同樣也是在有效性和安全性上優於國際其他產品的“中國抗體”。其不僅對目前已知的主要變異毒株均表現出了中和活性,治療窗口更是長達10天,明顯優於目前其他藥物3天、5天或7天的治療窗口,而其住院和死亡風險降低率高達80%,也同樣處於前列。
由於具有優秀的臨牀療效,因而在各地突發疫情之時,該聯合療法也作為唯一指定治療藥物,被送往疫情區域用於新冠患者的救治。2021年6月至11月5日,騰盛博藥共計提供了超過2300人份的安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)新冠中和抗體,支持了17個地區的18家醫院開展患者救治工作。截至11月5日,有近900例患者接受了安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)聯合療法的臨牀救治,包括輕型、普通型、重症、危重症患者,接受用藥的患者年齡最大的有92歲。
圖表二:支援疫情區域
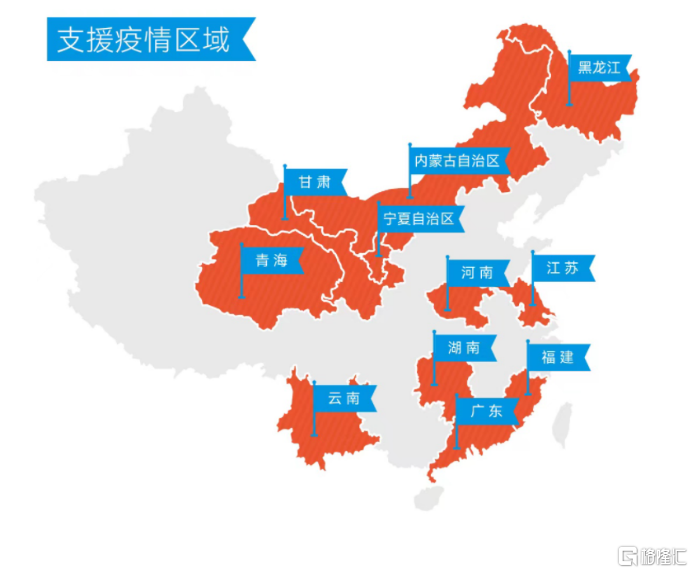
資料來源:公司官網,格隆彙整理
如此優秀的成績,得益於騰盛博藥、清華大學和深圳市第三人民醫院三方的共同努力,通過構建完善的產學研合作體系,充分發揮了各方的優勢。合作中,在清華大學張林琦教授的領導下,團隊迅速完成了包括解析病毒三維空間結構、定位作用靶點、闡明病毒分子機制等等前期工作。
隨後,騰盛博藥負責提供藥品開發專業知識、抗體優化、知識產權保護、項目管理、合同研發生產機構(CDMO)管理,以及臨牀試驗和藥品註冊的監督工作。憑藉騰盛博藥成熟完善的研發體系,迅速將基礎科研成果落地,實現商業化。
通過三方的緊密合作,安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)新冠中和抗體成功上市,而從目前已披露的數據來看,該中和抗體通過基因修飾將藥物半衰期延長到至少60天以上,因而未來其在預防新冠病毒感染領域或也將有優異表現。
未來通過疫苗的主動預防和中和抗體的被動預防,將有機會使包括疫苗無法覆蓋人羣在內的絕大多數人,均得到有效的防護,這或將助力疫情常態化後的防治工作,讓我們離真正戰勝疫情更進一步。
騰盛博藥邁入2.0新階段,迎來bio pharma時代
擁有“中國速度”的安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)新冠中和抗體背後,是一家發展速度同樣引人注目的公司——騰盛博藥。公司成立於2017年,至今僅僅4年,就已有產品成功進入商業化階段,對於一家創新藥企業而言,這樣的發展速度令人驚訝。
隨着公司首款產品上市開始銷售,公司也成功邁入了2.0階段,而作為一家專注於重大傳染病和中樞神經系統疾病兩大領域的創新藥企,公司的差異化管線佈局值得關注,除了已經上市的新冠中和抗體藥物,公司還擁有首個可能實現乙肝功能性治癒的藥物組合;給藥更佳便捷的抗HIV藥物;更廣譜的抗MDR/XDR革蘭氏陰性桿菌藥物;以及專門針對產後抑鬱症的藥物。
圖表三:產品管線圖
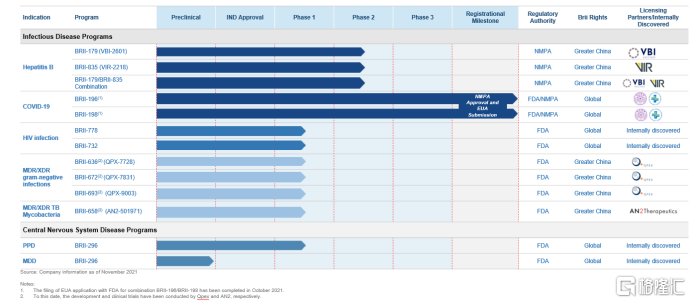
資料來源:公司公吿,格隆彙整理
差異化的管線帶來的是更強的競爭力,同時這樣的管線佈局也需要公司具備雄厚的人才優勢。創始人洪志博士曾是葛蘭素史克感染部門的高級副總裁和負責人,也是全球感染藥物開發的領軍人物。而總裁羅永慶則曾任吉利德中國區的總經理,領導了8個藥物的開發。此外,公司還擁有98人組成的研發團隊,以及強大的科學顧問委員會,保障了公司強大研發創新實力。
基於公司團隊過往在跨國藥企的經驗,騰盛博藥從創立之初就具備了全球化的基因,在全球化方面早早佈局,針對歐美市場公司佈局了抗HIV藥物,針對國內市場則發力抗HBV藥物,面對全球疫情則開發了安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)。在當前國內有實力的創新藥企業紛紛“出海”的格局下,騰盛博藥這一系列具備相對優勢的產品管線或也將在未來迎來“出海”機會。
在商業化佈局方面,在安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)新冠中和抗體BLA獲批之前,公司就已經提前佈局,追加1億美元該療法的註冊申請及商業化,同時還任命了曾在吉利德任職的Coy Stout為公司高級副總裁、美國市場準入和患者權益倡導負責人。隨着產品正式獲批,中和抗體的生產及銷售也逐步鋪開,騰盛博藥也從一家biotech企業變成了bio pharma。新冠中和抗體的上市不僅證實了公司強大的創新能力,也是公司長期價值的體現。
小結
此次安巴韋單抗/羅米司韋單抗(BRII-196/BRII-198)新冠中和抗體BLA迅速獲批,無疑又一次彰顯了我國抗疫的“中國速度”。實際上在藥物獲批過程中,藥監局採取的一系列支持措施,也有力加快了新藥的上市進程,是監管機構保護和促進公眾健康理念的一種體現,是從保護危重患者利益出發的靈活制度設計。在新冠疫情常態化的大背景下,騰盛博藥的新冠中和抗體將為我國的新冠治療帶來零的突破,惠及更多新冠患者。
對於騰盛博藥而言,同樣意義非凡,一方面意味着公司正式擁有了自我造血能力,未來將通過該藥物的銷售為公司提供可持續的現金流,以支持公司後續的發展。另一方面也驗證了公司強大的成長能力,機會從來是留給有準備的人,騰盛博藥能在如此短的時間取得這樣的成果,和其本身的強大實力密不可分,公司未來的更多可能性值得期待。




