本文來自格隆匯專欄:國泰君安證券研究
摘要
抗體偶聯藥物(Antibody Drug Conjugate,ADC)是通過連接子將化學小分子毒素與單克隆抗體偶聯而形成的組合藥物,兼具抗體的靶向性和化學藥物的殺傷效應,在腫瘤治療領域具有極大的應用價值。
近年來,隨着連接子、偶聯技術、小分子毒素以及基因工程等技術的不斷髮展,ADC藥物逐步克服早期難題,進入快速發展階段。2020年1月,羅氏的ADC藥物Kadcyla在中國獲批上市。2021年6月,榮昌生物的愛地希作爲首個國產ADC藥物獲附條件批準,標誌着中國ADC藥物商業化進程正式開啓。未來幾年,隨着國產ADC藥物的陸續落地,其市場容量也將持續擴大。
但整體來看,目前我國的ADC藥物產業發展仍處於“fast follow”階段。隨着競爭的日益激烈,能否通過自身的核心技術平臺在ADC藥物的靶點、連接子、偶聯方式及適應症等方面構築差異化優勢,將是企業能否脫穎而出的關鍵所在。
導讀:
2019~2020年,FDA批準了5個抗體偶聯(Antibody Drug Conjugate,ADC)藥物,開啓了ADC市場黃金髮展期的序幕。ADC藥物兼具化藥殺傷性和單抗靶向性的優勢,市場前景廣闊;但同時,其研發難度也遠高於化藥和普通抗體藥物。隨着國內藥企和資本亦紛紛入局,具備領先技術平臺的ADC企業有望在競爭中佔得先機。
一、 ADC藥物:“增效減毒”的藥物明星
1.1
ADC藥物是單抗和小分子毒素的結合
癌症是威脅人類健康的第一殺手。根據世界衛生組織國際癌症研究中心(IARC)發佈的2020年全球癌症負擔數據,2020年全球癌症新發病例和死亡病例分別爲1929萬例和996萬例,相較於2018年分別增長6.2%和3.6%。目前,化療仍是癌症治療的主要手段之一,多種化療藥物已被應用於腫瘤的臨牀治療。然而,大部分化藥都面臨較大的毒副作用和腫瘤耐藥性問題,這在一定程度上限制了化療藥物的臨牀應用。1975年,雜交瘤技術的突破解決了單克隆抗體的大規模製備難題。隨後,基因工程和蛋白工程技術快速發展,人源化和全人源單抗的誕生克服了抗體的免疫原性問題,單抗藥物在抗腫瘤領域大放異彩。與此同時,單抗與抗原特異性結合的能力,使其可能成爲化學藥物有效的靶向遞送工具,有望解決小分子化藥的系統副作用問題,ADC藥物概念的提出即是基於上述思路。ADC藥物是指將有殺傷效應的小分子毒素通過連接子以特定的連接方式偶聯至單克隆抗體,從而提高小分子藥物的靶向性、同時減少毒副作用、增強其腫瘤細胞殺傷活性。
圖1 ADC是單抗、小分子毒素和連接子的“組合體”
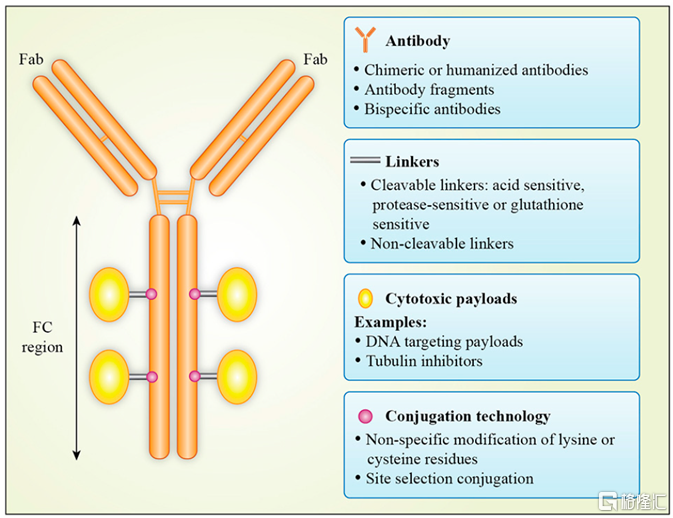
資料來源:Molecules
1.2
ADC藥物兼具靶向性和殺傷力優勢
作爲由抗體和小分子毒素組成的“組合藥物”,ADC藥物兼具抗體的高靶向性和化學藥物的強殺傷力特徵。通過靜脈注射進入體內後,ADC藥物通過抗體與腫瘤細胞表面抗原特異性結合,誘導細胞的內吞和胞飲作用,將ADC吞入細胞內;隨後,ADC中的抗體或連接子會被細胞內的酶類或其他物質降解,從而釋放出小分子毒素,小分子毒素通過DNA 插入或抑制微管合成等方式導致細胞凋亡。除此之外,ADC藥物還可通過“旁觀者效應”(Bystander Killing)對癌細胞造成殺傷,即在腫瘤細胞外釋放的或從已凋亡腫瘤細胞中泄露出來的小分子毒素,可通過擴散進入周圍的腫瘤細胞或抗原低表達的腫瘤細胞,繼續發揮殺傷作用。通過對作用機理的分析可以發現,ADC藥物正是藉助抗體的高特異性優勢,將抗腫瘤小分子毒素精準遞送到腫瘤區域和腫瘤細胞,使其在腫瘤細胞內富集併發揮殺傷作用,同時減少對其他正常細胞的毒副作用,進而提高最大耐受劑量、降低最小有效劑量、擴大治療窗口,在普通化療的基礎上實現了“增效減毒”。
圖2 ADC藥物的作用機理
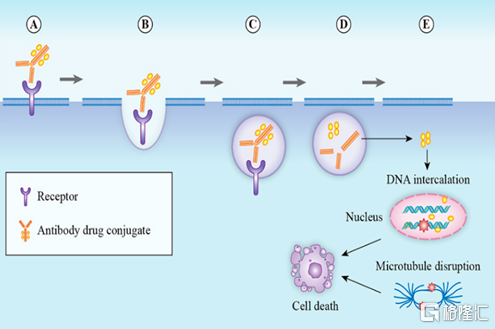
資料來源:Molecules
圖3 ADC藥物的特異性優勢擴大化學藥物的治療窗口
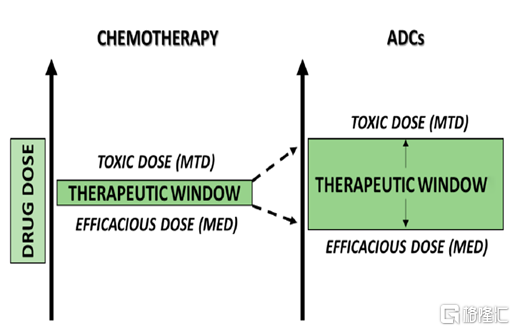
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
二、ADC藥物的成功取決於五大要素的設計
2.1
靶向抗原:特異性是關鍵
靶向抗原的選擇與ADC藥物的特異性密切相關,是ADC藥物設計的關鍵一環。理想的靶向抗原需滿足多個條件:
(1)腫瘤細胞高表達、正常細胞低表達或不表達
現實情況中,僅有腫瘤細胞表達而正常細胞不表達的腫瘤特異性抗原(tumor-specific antigens,TSA)種類很少。因此,目前ADC選擇的靶向抗原多爲腫瘤相關抗原(tumor‐associated antigens,TAA),即腫瘤細胞高表達、正常細胞低表達的抗原。例如,研究較爲成熟的靶點HER2(人類表皮因子生長受體2),其在腫瘤細胞表面的平均表達量爲2 x 106/細胞,而在正常細胞表面的平均表達量僅爲2 x 104/細胞,二者相差100倍。
(2)靶向抗原需爲腫瘤細胞表面抗原
從作用機理來看,ADC藥物中的抗體需與腫瘤相關抗原發生特異性相互作用後才能繼續進行後續的內吞、藥物釋放等環節。因此,靶向抗原需在腫瘤細胞表面表達,且能夠順利地與ADC藥物中的抗體接觸並結合。
(3)能夠高效誘導內在化過程 (internalization)
儘管ADC藥物理論上可在腫瘤細胞外釋放毒素,不經過細胞內在化,通過“旁觀者效應”對腫瘤細胞造成殺傷,但目前大部分ADC藥物療效的實現均是以內在化後的藥物釋放爲基礎。因此,ADC藥物中的抗體和腫瘤細胞表面抗原結合後,ADC-抗原複合物需能有效誘導內在化過程,進入腫瘤細胞內,並通過適當的細胞內轉運和降解過程,實現小分子藥物的有效釋放。
目前已上市和在研的ADC藥物中,HER2是針對實體瘤應用最爲廣泛的靶點,CD(人白細胞分化抗原)系列抗原是血液瘤靶點的首選。值得一提的是,與抗體藥物不同,ADC藥物的殺傷作用主要通過小分子毒素實現,對靶點抗原在生物學效應方面的要求較低。理論上,ADC藥物靶向抗原的選擇範圍比抗體藥物更大,在腫瘤細胞表面或腫瘤微環境中過表達的抗原均可以作爲ADC藥物潛在的靶點。因此,未來ADC藥物的適應症及藥物種類將比抗體藥物更加豐富。
表1 ADC藥物常見的靶點及其對應的腫瘤
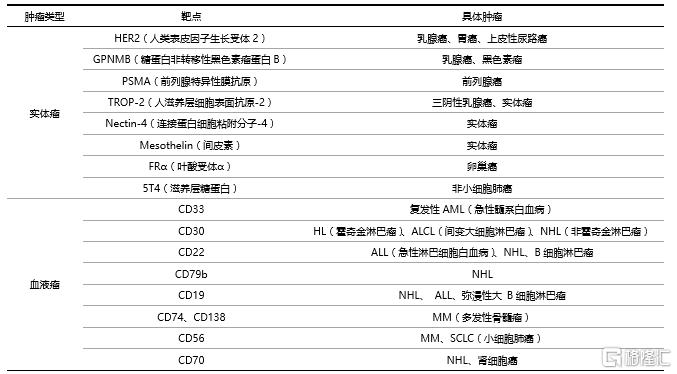
資料來源:ADC Review,國泰君安證券研究
2.2
抗體:高特異性、高親和力、低免疫原性爲主要考慮因素
ADC藥物中理想抗體的基本特徵之一即是對所選擇抗原具有高度特異性。若缺乏特異性,ADC藥物則可能與其他抗原發生預期外的交叉反應,進而造成脫靶毒性或被過早清除。此外,與靶點抗原的高親和力以及在體內的低免疫原性是保證ADC藥物在血液中有較長循環時間以及順利進入腫瘤細胞的基礎。最後,若抗體與抗原結合後,能通過直接調節抗原的生物活性或其他方式抑制癌細胞生長,即抗體本身具有抗癌活性,則會進一步增加ADC藥物的藥理作用。
人體內的抗體可主要分爲IgA、IgD、IgE、IgG和IgM,基於結構、體內含量、循環時間等方面的優勢,目前幾乎所有的ADC藥物均選擇了IgG作爲抗體骨架。IgG可進一步分爲四種亞型,即IgG1、IgG2、IgG3和IgG4,每一種亞型在結構和生物活性方面存在一定差異。
(1)在半衰期方面:IgG3在血液中的半衰期僅爲IgG1、IgG2和IgG4的三分之一,因此,IgG3幾乎不會被用作ADC藥物的抗體;
(2)結構和穩定性方面:IgG4會發生Fab臂交換,可能形成新的雜合IgG4。此外,IgG4在低pH條件下易發生聚集。IgG2具有18個雙硫鍵(IgG1和IgG4具有16個),理論上可結合更多小分子毒素,但IgG2 具有獨特的二硫鍵異構結構和更復雜的鉸鏈區,導致其開發難度大大提升;
(3)抗體生物活性方面:與IgG2和IgG4亞型相比,IgG1和IgG3具有更強的ADCC(抗體依賴細胞介導的細胞毒性作用)和CDC(補體依賴的細胞毒性作用)活性。但也有研究認爲,ADCC和CDC活性可能會影響細胞對於ADC藥物的內吞。因此,上述活性是否有助於ADC藥物發揮整體藥效尚無定論。
基於上述分析和ADC藥物抗體選擇的邏輯,IgG1成爲目前ADC藥物中最常用的亞型。隨着技術的進步,IgG4也逐步應用於ADC藥物的開發,輝瑞公司的ADC產品即普遍採用IgG4亞型。考慮到IgG不同亞型各有的優勢,後續的ADC藥物研發中可選擇不同亞型的重、輕鏈進行重組以產生具備綜合優勢的抗體。此外,對於抗體的體外修飾,特別是Fc段的糖基化修飾以增強ADCC和CDC活性或降低免疫原性也將是ADC藥物中抗體研發的方向。
表2 不同IgG亞型的特徵對比

資料來源:國泰君安證券研究
2.3
連接子:穩定性和釋放效率的平衡
連接子將小分子毒素偶聯至單克隆抗體,也是ADC藥物設計的關鍵因素之一。理想的連接子必須滿足兩個條件:(1)在血液循環系統中保證ADC藥物的穩定性,循環過程中過早的藥物釋放將導致全身毒性,同時會降低ADC藥物的治療指數;(2)當ADC藥物到達腫瘤區域或腫瘤細胞內後,小分子毒素能快速、高效地釋放。目前,應用於ADC藥物的連接子主要分爲兩大類:可裂解連接子和不可裂解連接子。
2.3.1
不可裂解連接子:更具穩定性優勢
不可裂解連接子在血清中展現出非常高的穩定性,因此,基於不可裂解連接子的ADC藥物在循環過程中的小分子毒素釋放極少,系統毒性更小,治療窗口也更寬,耐受性更高。對於使用不可裂解連接子的ADC藥物,小分子毒素的釋放依賴其進入細胞後整個抗體蛋白結構被溶酶體降解,因此,降解後的小分子毒素上通常還會殘留連接子以及少量氨基酸序列,這可能會影響小分子毒素的生物活性,也是連接子設計時需考慮的問題。目前,最常用的不可裂解連接子爲基於硫醚鍵的連接結構。
圖4 使用不可裂解連接子硫醚鍵的ADC藥物huC42–SMCC–DM1
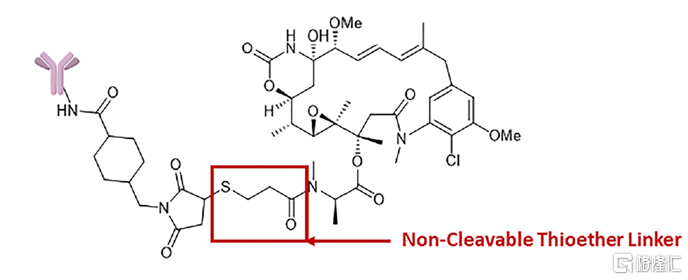
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
2.3.2
可裂解連接子:釋放效率更高
可裂解連接子利用血液循環系統與腫瘤微環境或腫瘤細胞內環境之間的差異,通過分子的設計,使連接子在血液環境中保持穩定,而在腫瘤微環境或腫瘤細胞內受到特定刺激而裂解,進而釋放出小分子毒素。目前,最常用的刺激連接子裂解的條件包括:
(1)弱酸性環境
研究發現,腫瘤部位多呈弱酸性,且細胞溶酶體內的pH爲4.5~6,因此,用酸敏感的連接子將小分子毒素與單抗連接,能有效實現小分子毒素在腫瘤部位的可控釋放。
(2)還原性環境
研究表明,腫瘤細胞內還原性物質谷胱甘肽(GSH)的濃度爲2~10mM,遠高於血液中GSH的濃度(2μM)。因此,還原性敏感的連接子在血液中能穩定存在,到達腫瘤細胞後,在還原性的條件下斷裂,進而釋放小分子毒素。
(3)蛋白酶水解環境
腫瘤細胞的溶酶體中存在某些能夠識別和高效降解特定多肽鏈或其他某種物質的蛋白酶,因此,用可酶解的分子,例如纈氨酸-瓜氨酸二肽、β-葡萄糖苷酸等作爲連接子,同樣可以實現小分子毒素的可控釋放。
根據不同的裂解條件,可裂解連接子大致可分爲三類:酸敏感的腙鍵、還原敏感的二硫鍵和酶敏感的肽類或其他分子。
圖5 四種典型的可裂解連接子
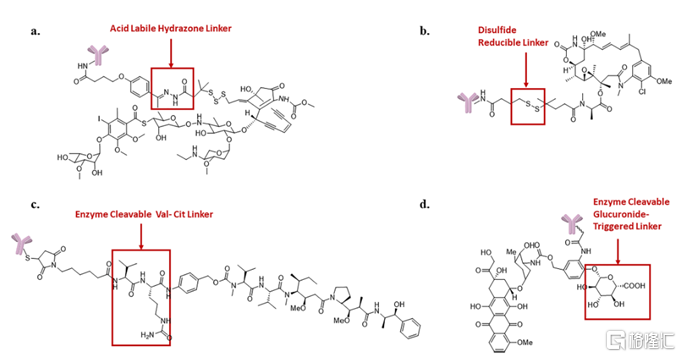
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
與不可裂解連接子相比,可裂解連接子的小分子藥物釋放多了一條路徑,因而釋放效率往往更高。另一方面,在現實情況中,使用可裂解連接子的ADC藥物在循環系統中的穩定性表現各異,長時間在血清中也會發生一定程度的裂解和藥物釋放。例如,實驗發現使用含腙鍵連接子的ADC藥物Mylotarg(吉妥珠單抗奧佐米星)在生理pH條件下腙鍵也能少量斷裂,這也可能導致藥物脫靶毒性。
表3 ADC藥物的連接子分類

資料來源:國泰君安證券研究
2.3.3
連接子選擇需考慮的其他因素
除了穩定性和小分子釋放效率外,連接子的選擇可能還會影響到ADC藥物其他方面的性質。例如,研究發現,增加連接子的親水性可以避免攜帶連接子殘基的小分子毒素被腫瘤多藥耐藥相關的轉運蛋白排出至細胞外而無法發揮殺傷效力。此外,還有研究表明,非極性的連接子殘基有助於小分子毒素穿過細胞膜,增強其旁觀者效應;而高極性或帶電荷的連接子殘基很難穿透細胞膜,無法實現旁觀者效應。由此可見,ADC藥物的連接子選擇需綜合考慮多種因素,達到穩定性、釋放效率及其他生物活性的平衡。
2.4
偶聯技術:最優DAR的保障
偶聯技術是通過連接子將單抗和小分子毒素連接到一起的過程中所涉及的化學反應、抗體修飾與改造等相關技術。ADC藥物所採用的偶聯技術與其最終的藥物抗體比率DAR(Drug to Antibody Ratio)密切相關,而DAR的數值及其分佈會顯著影響ADC藥物性質。DAR過大,由於小分子毒素的疏水性,可能導致ADC藥物的聚集,進而在循環系統中被清除;DAR過小,ADC藥物可能無法達到理想的治療效果。目前普遍認爲,DAR在2~4之間是ADC藥物的最優選。DAR的分佈則代表了ADC藥物的均一性,若DAR分佈較寬,則ADC藥物均一性差,會導致其藥代動力學研究更加複雜,進而影響ADC藥物的有效性和安全性。此外,偶聯技術的選擇還需考慮一些其他因素,例如,化學反應或修飾應當不會對抗體和小分子毒素的生物活性造成破壞、後續的分離純化需操作簡單便捷等。目前,常用的偶聯技術可分爲隨機偶聯和定點偶聯兩大類。
2.4.1
隨機偶聯
隨機偶聯是早期ADC藥物常採用的偶聯方式,通常是藉助抗體骨架上賴氨酸殘基中的氨基(-NH2)或半胱氨酸殘基上的巰基(-SH)實現偶聯。
(1)通過賴氨酸殘基偶聯
研究發現,平均每個抗體上分佈有80~100個賴氨酸氨基,這些氨基是很好的親核試劑且充分暴露,是較理想的連接子結合位點。常用的與賴氨酸氨基進行偶聯反應的化學分子包括活化酯類、馬來酰亞胺或滷代酰胺等,上述分子通過將氨基烷基化或酰化實現藥物偶聯。採用氨基偶聯的ADC藥物包括Mlotarg(吉妥珠單抗奧佐米星)、TDM-1(曲妥珠單抗-美坦新偶聯物)。
圖6 IgG1上的賴氨酸殘基以及與之發生偶聯反應的連接子-小分子毒素 ADC藥物的作用機理
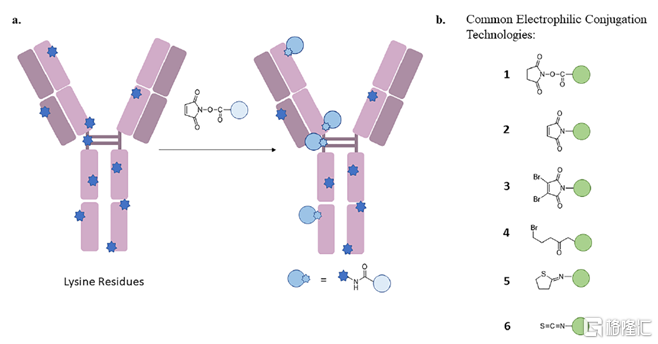
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
(2)通過半胱氨酸殘基(二硫鍵)偶聯
IgG抗體內含有多個二硫鍵,其中鏈內的二硫鍵被包含在兩條反向平行的β摺疊鏈之間,無法暴露在溶劑中,通常比較穩定,不易被打開。而鏈間的二硫鍵則高度暴露在溶劑中,能夠被還原性試劑(如DTT)還原形成巰基。這些巰基可以與帶有活化酯、馬來酰亞胺等親電基團的連接子-小分子毒素複合物發生化學反應,進而實現偶聯。以IgG1爲例,IgG1含有四個鏈間二硫鍵,被還原後最多可暴露出8個巰基,理論上每個IgG1抗體最多可連接8個小分子藥物。基於二硫鍵偶聯的ADC藥物包括Brentuximab vedotin等。
圖7 IgG1上部分二硫鍵部分還原以及與之發生偶聯反應的連接子-小分子毒素
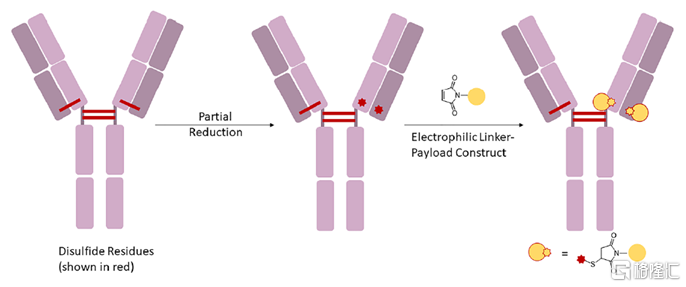
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
儘管偶聯反應容易發生,但隨機偶聯難以控制偶聯位置和數量,得到的ADC產物實際上是具有不同DAR的非均勻混合物,難以重複和改進設計,同時使藥物分佈與代謝變得更爲複雜,影響藥物的有效性和安全性。
2.4.2
定點偶聯
隨機偶聯導致的產物多樣性爲ADC藥物的藥代動力學、耐受性和藥效等多個指標的研究帶來一定障礙,因此,近年來定點偶聯技術的重要性日益凸顯。定點偶聯技術能夠將小分子毒素偶聯至抗體的特定位點,確定性高,能得到DAR分佈更窄且相對均一的ADC產物。目前,常用的定點偶聯技術包括引入反應性半胱氨酸、二硫鍵改造、引入非天然氨基酸、酶催化法等。
(1)引入反應性半胱氨酸
該技術是指利用基因工程技術在抗體分子中的特定位置插入半胱氨酸殘基,通過半胱氨酸殘基上的巰基與小分子毒素進行偶聯,進而得到結合位點專一、DAR更加確定的ADC藥物。基因泰克公司(Genentech)的Thiomab技術是最具代表性的通過引入反應性半胱氨酸實現定點偶聯的技術平臺,該技術是在抗體特定位置處插入兩個半胱氨酸殘基,然後通過巰基和連接子的反應實現定點偶聯。通過Thiomab技術得到ADC藥物中DAR=2 的產物高達92.1%,與隨機偶聯方式相比,產物的均一性大大提高,同時這種定點偶聯的方式既不會幹擾IgG抗體的摺疊和組裝,也不會改變抗體和靶點抗原的結合模式。除了基因泰克公司外,Seagen的MAIA技術也是基於類似的原理。
圖8 Thiomab技術示意圖
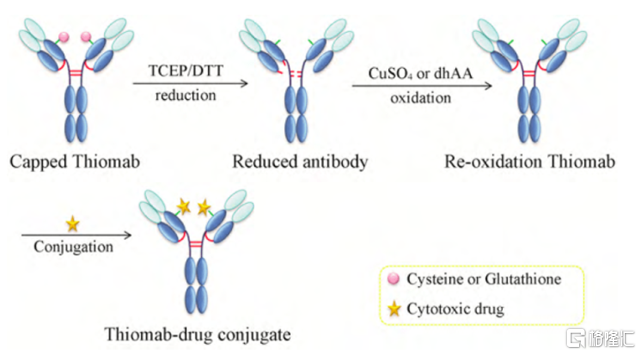
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
(2)二硫鍵改造技術
英國Abzena公司的ThioBridge技術是典型基於二硫鍵改造的定點偶聯技術,其原理是將單抗本身的二硫鍵還原,利用含有二溴(或二磺酸鹽)的連接子試劑與還原的鏈間二硫化物反應,實現抗體和小分子毒素的定點偶聯。與前述的通過半胱氨酸殘基的偶聯方式不同,ThioBridge技術中二硫鍵還原產生的兩個巰基與一個連接子對應的兩個親電位點發生反應,這種“雙偶聯”方式大大提高了連接的區域專一性,得到的ADC藥物更加均一且穩定。以IgG1爲例,通過ThioBridge技術,主要得到DAR=4的ADC產物。
圖9 ThioBridge技術示意圖
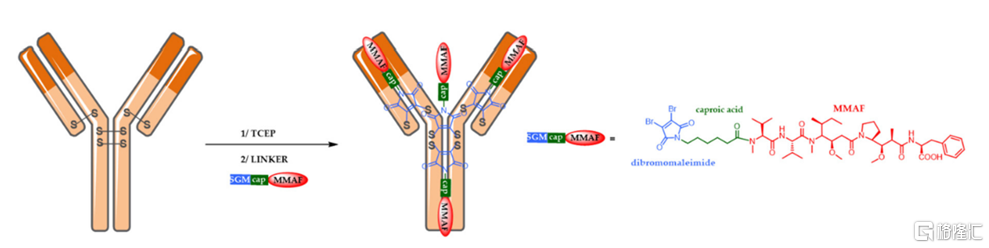
資料來源:Pharmaceuticals
(3)引入非天然氨基酸
通過生物正交反應(在活體細胞或組織中能夠在不幹擾生物自身生化反應條件下進行的化學反應)在生物體內的目標蛋白上引入非天然氨基酸,同樣可以在單抗上創造特異性結合位點,實現抗體和藥物分子的定點偶聯。例如,Ambrx公司的EUCODE 技術平臺即是基於能特異性識別非天然氨基酸的酪氨酰-tRNA/氨酰-tRNA合成酶,在合成的抗體中引入對乙酰苯丙氨酸殘基,然後再與羥胺發生肟化反應,主要得到DAR=2的ADC產物。
圖10 引入非天然氨基酸實現定點偶聯示意圖
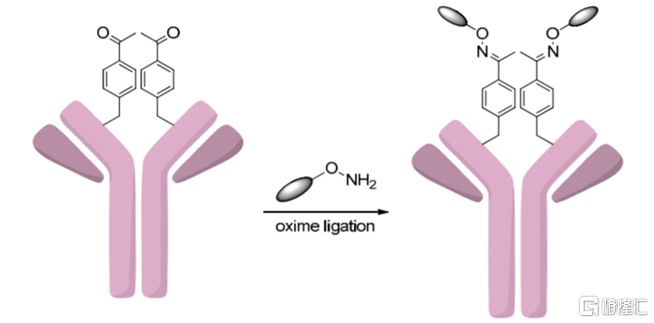
資料來源:Int. J. Mol. Sci
(4)酶催化法偶聯
酶催化法偶聯是指利用基因工程技術使抗體中產生能被某類酶特異識別的特定氨基酸序列,再利用這種酶對氨基酸序列的特異性作用,將其中的特定氨基酸殘基進行改造,使其帶上活性反應位點,進而與連接子反應實現定點偶聯。目前,該方法主要使用的酶包括轉谷氨醯胺酶、糖基轉移酶和分選酶A等。以分選酶 A (Srt A)爲例, Srt A能識別抗體蛋白中的LPETG序列,並裂解蘇氨酸(T)和甘氨酸(G)間的肽鍵,然後催化其與甘氨酸修飾的小分子毒素之間形成新的TG肽鍵,實現抗體和藥物的定點偶聯。
圖11 分選酶A催化偶聯示意圖
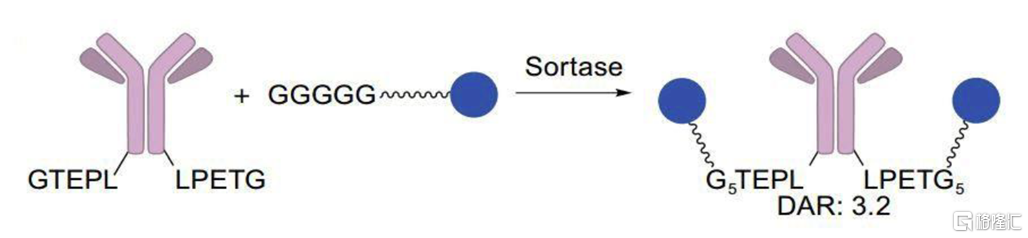
資料來源:Int. J. Mol. Sci.
2.5
小分子毒素:高毒性和可修飾性爲基本條件
小分子毒素是ADC藥物發揮殺傷活性的主要成分。由於ADC藥物獨特的作用機理,在選擇小分子毒素時亦需綜合考慮毒性、可修飾性等多個因素。
(1)與普通化學藥物相比,具有顯著更高的毒性
腫瘤細胞對單抗的攝取率非常有限,通常小於每克腫瘤注射劑量的0.003-0.08%。此外,ADC藥物上可連接的小分子毒素數目也受限於各種因素。因此,用於ADC藥物的小分子毒素必須具有極高的毒性,在極少的分子進入細胞內的條件下實現對腫瘤細胞的有效殺傷。
(2)可修飾性
小分子毒素需要與連接子相連,然後偶聯至單抗。因此,小分子毒素的分子結構中必須含有可修飾的化學基團,能夠高效地與連接子發生化學反應,且修飾後不影響小分子毒素的活性。
(3)適當的親疏水平衡
小分子毒素的親疏水性將影響ADC藥物的穩定性和活性。一方面小分子毒素需具備一定的親水性,能夠在水溶劑中與抗體進行偶聯反應,避免引入有毒的有機溶劑,同時高的親水性也能避免ADC藥物的聚集;而另一方面,若小分子毒素親水性過高,則其“旁觀者效應”可能減弱,殺傷效果可能降低。因此,小分子毒素需要具備適當的親疏水平衡。
(4)較高的穩定性
ADC藥物在製備和生產過程中,會經歷多個合成步驟,接觸多種溶劑或製劑,小分子藥物需在這些過程中保持化學結構和性質的穩定。
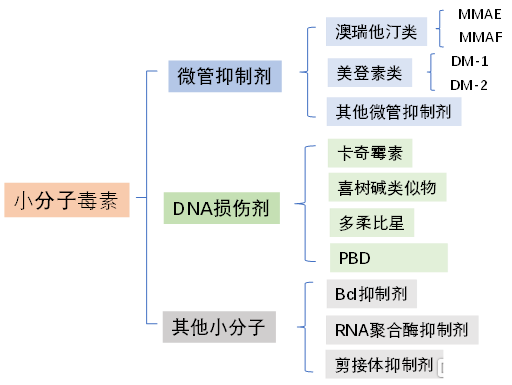
目前,常用的小分子毒素通常可分爲三大類:微管抑制劑、DNA 損傷劑以及其他小分子,如α-鵝膏毒素(一種選擇性 RNA 聚合酶II抑制劑)。
微管抑制劑能夠抑制有絲分裂中微管的形成,幹擾有絲分裂,導致細胞死亡。這種細胞殺傷機制在快速增殖的細胞(如癌細胞)中非常有效,但對非分裂和靜態細胞(如體細胞)殺傷力較弱。美登素類化合物(Maytansinoids)和澳瑞他汀類化合物(Auristatin)是目前ADC開發中應用最爲廣泛的兩種微管抑制劑。已獲批上市的ADC藥物中,TDM-1即是以美登素衍生物DM-1爲小分子毒素,Brentuximab Vedotin則是以澳瑞他汀衍生物MMAE爲小分子毒素,上述兩類分子也是目前在研的大部分ADC藥物所使用的有效荷載。
DNA損傷劑通過與DNA的雙螺旋小溝結合,並誘導DNA鏈的烷基化、斷裂或交聯,進而發揮其細胞毒性作用,代表藥物包括卡奇黴素(Calicheamicins)、喜樹鹼類似物(camptothecins)、吡咯並苯並二氮卓(PBD)等。已上市的ADC藥物Mylotarg即是以卡奇黴素衍生物作爲小分子毒素。
近年來,其他小分子毒素如RNA聚合酶抑制劑、剪接體抑制劑等也逐漸被應用於ADC藥物的開發。
圖12 ADC藥物開發中常用的小分子毒素
資料來源:國泰君安證券研究
綜上,一個完整的ADC藥物包括抗體、連接子、小分子毒素三個部分,其研發和生產過程還涉及到靶向抗原以及偶聯方式的選擇。這五個關鍵要素的選擇和設計將直接影響ADC藥物的臨牀性質。對上述五個因素進行不斷改進和優化,提升ADC藥物的穩定性、安全性和有效性,仍將是未來幾年該行業面臨的主要挑戰。
三、漫長的技術突破,ADC行業終入收穫期
3.1
ADC藥物經歷三代發展
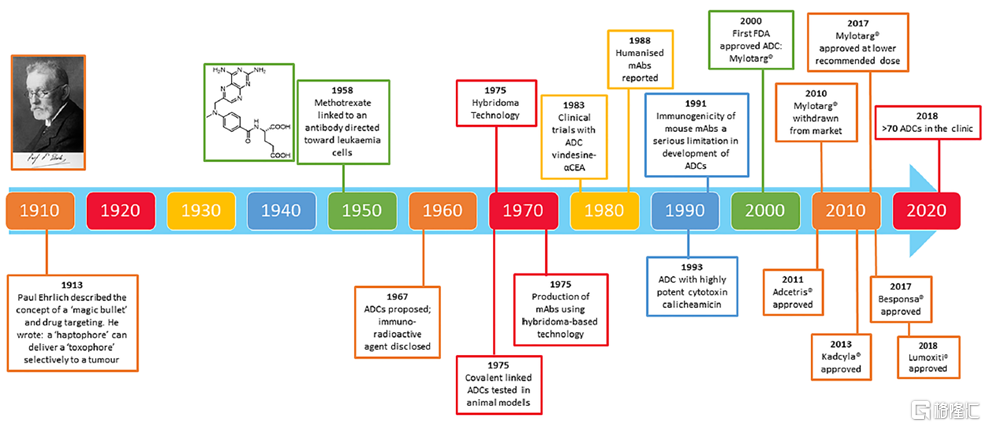
早在1900年代,德國科學家、化療之父Paul Ehrlich就首次提出了ADC的概念,他將其稱之爲“魔法子彈”(magic bullet),寓意爲這種藥物可以通過藉助其他物質將毒素分子運輸至特定的細胞。此後的五十餘年,ADC藥物的研究未取得實質性進展。直到1958年,隨着化學偶聯技術的突破,Mathe首次將小分子毒素甲氨蝶呤偶聯至多克隆齧齒動物免疫球蛋白,用於白血病的治療。此後,ADC藥物仍由於免疫原性和抗體制備等問題而發展緩慢。1970年代雜交瘤技術的誕生以及1980年代人源化抗體等相關技術的出現,大大推動了ADC藥物的發展,使其在體外細胞試驗和動物實驗中取得較好的效果,並開始出現了ADC藥物的臨牀試驗。2000年,輝瑞開發的用於治療急性髓細胞樣白血病的ADC藥物Mylotarg獲FDA批準,成爲該領域第一款獲批藥物,此時距ADC概念的提出已接近百年。此後,ADC藥物的研究仍面臨抗原選擇性差、細胞毒性低、不可控藥物釋放等問題,Mylotarg也由於被發現有嚴重的致命性肝損傷而在2010年撤市,這給企業對於ADC藥物的開發熱情造成不小打擊。2017年,在經過給藥劑量調整之後,FDA重新批準Mylotarg上市。此時,包括Mylotarg在內,全球僅有3款ADC藥物獲批上市。但隨着在抗體、連接子、小分子藥物和偶聯技術等方面前期研發的積累和快速突破,ADC藥物研究日益成熟,2017年後,ADC藥物的獲批速度顯著加快,行業也進入快速發展階段。
圖13 ADC藥物的曲折發展之路
資料來源:Cytotoxic Payloads for Antibody–Drug Conjugates
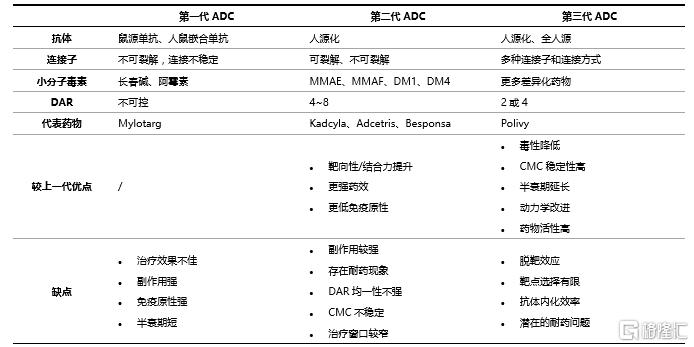
從第一款ADC藥物獲批後,伴隨着各類問題被不斷解決與優化,目前已經發展出不斷改進的三代ADC產品。
(1)第一代ADC藥物
第一代ADC藥物通常都使用鼠源抗體或人鼠嵌合抗體,存在較大的免疫原性。同時,藥物在血清中過多解離而導致安全性和治療性的弱化,治療窗口較窄。第一代ADC藥物的代表是輝瑞的Mylotarg,它是抗CD33抗體和卡奇黴素的結合體,用於治療白血病。Mylotarg上市後由於安全性問題被撤回,經過給藥劑量調整後被FDA重新批準上市。
(2)第二代ADC藥物
第二代ADC藥物除了在抗體和小分子毒素上有改進,還選用了穩定性更高的連接子,因此與第一代ADC藥物相比具有更優良的臨牀療效和安全性,但其治療窗口仍較窄。第二代ADC藥物的代表有武田的Adcetris和羅氏的Kadcyla,前者爲靶向CD30的IgG1單抗連接4個MMAE的ADC藥物,於2011年上市;後者爲靶向HER2的IgG1單抗連接3個或者 4個DM1的ADC藥物,於2013年獲批上市。
(3)第三代ADC藥物
第三代ADC藥物在連接子和小分子毒素方面有了更大的進步,通過將小分子毒素與單克隆抗體定點偶聯,產生DAR爲2或4、均一性更高的ADC藥物,從而降低藥物毒性,減少未結合的抗體,提高藥物的穩定性和藥代動力學效率。第三代ADC藥物的代表爲Polivy,是靶向CD79b的單抗與MMAE的偶聯藥物,於2019年獲批上市。
表4 三代ADC藥物比較 不同離子源的特點及適用樣品
資料來源:浦銀國際,國泰君安證券研究
3.2
藥物加速獲批,行業進入快速發展期
3.2.1
全球市場:藥品獲批節奏加快,各大藥企掀起研發高潮
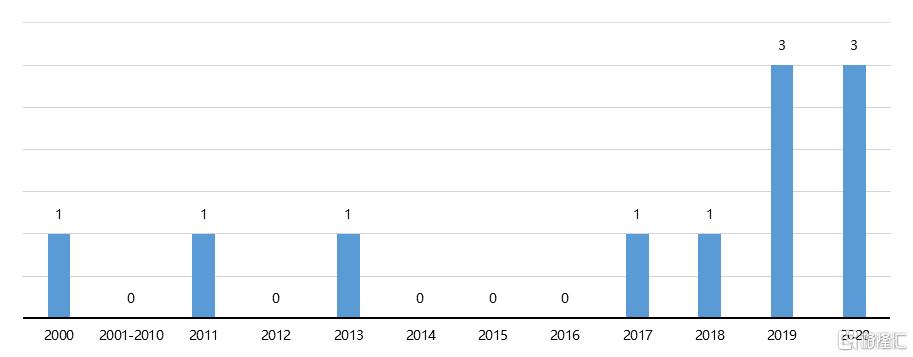
(1)ADC藥物迎來密集上市期
從2000年第一個ADC藥物獲批以來,截至2021年5月,全球已有12款ADC藥物獲批上市。特別是2019年以後,受益於前期技術積累、製藥企業對於ADC藥物各大要素的選擇和設計日益成熟,ADC藥物的各項治療指標顯著提升,相對於化藥的臨牀優勢也逐漸凸顯,FDA對於ADC藥物的審批節奏明顯加快。
圖14 2019年後ADC藥物獲批數目快速增加(單位:款)
資料來源:國泰君安證券研究
表 5 全球已獲批ADC藥物情況
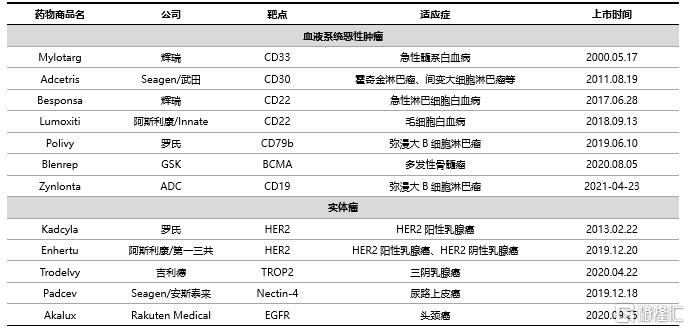
資料來源:國泰君安證券研究
(2)研發熱情高漲,藥企紛紛佈局
技術的突破提升了ADC藥物的研發效率,審批節奏的加快以及巨大的市場空間使得製藥界對ADC 藥物開發的熱情高漲。根據Clarivate統計,截至2020年7月,全球分別有188款ADC藥物處於臨牀II期,8款處於臨牀III期,2款處於上市申請階段。ADC藥物的靶點以及腫瘤適應症也在迅速增加。未來幾年,預計將有多款ADC藥物陸續上市。
圖15 全球在研ADC藥物研發階段分佈(單位:款)
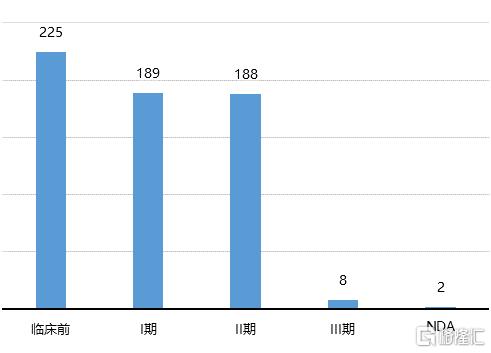
資料來源:Cortellis,國泰君安證券研究
注:數據截至2020年7月14日
圖16 全球在研ADC藥物適應症數目變化趨勢(單位:個)
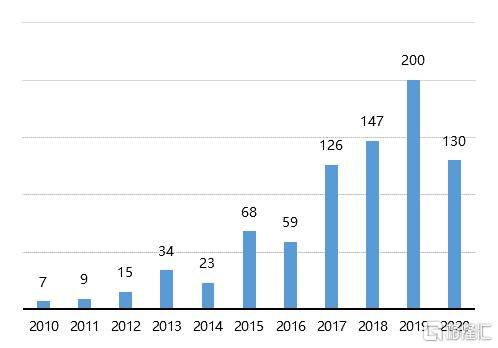
資料來源:Cortellis,國泰君安證券研究
注:數據截至2020年7月14日
從市場格局來看,ADC藥物研發實力強、管線多的企業幾乎都來自歐美和日本。Seagen自研或合作開發的ADC藥物管線最廣,共計35個;羅氏排名第二,共計25個;吉利德緊隨其後,共計23個。2020年9月份,吉利德以總值210億美元收購了ADC企業Immunomedic公司,進一步奠定了其在ADC藥物領域的行業領先地位。
圖17 全球ADC藥物管線佈局領先企業(單位:個)
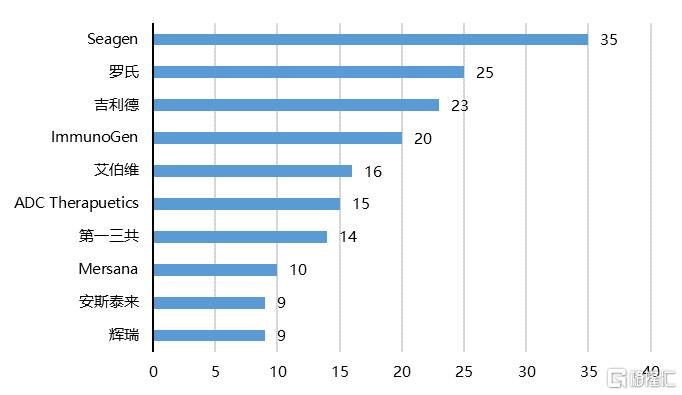
資料來源:Cortellis,國泰君安證券研究
注:數據截至2020年7月14日
(3)市場快速增長,行業前景廣闊
2021年3月,發表於Nature Reviews Drug Discovery上的一篇綜述文章預測,到2026年,全球目前已上市ADC藥物的市場規模將超過164億美元。而在2020年,全球ADC藥物領域的授權和併購交易額超過400億美元,足以體現市場和企業對ADC藥物發展潛力的看好。未來,隨着新的ADC藥物不斷獲批落地,以及ADC藥物在適應症方面的不斷延伸,其市場規模將遠超預估值。
圖18 已上市ADC藥物的市場規模預測
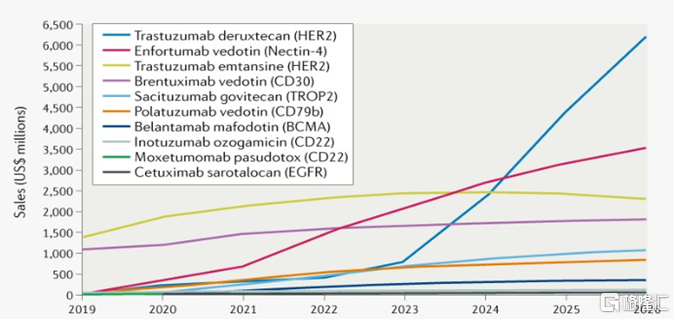
資料來源:Nature Reviews Drug Discovery
3.2.2
中國市場:開啓商業化元年,國內企業快速追趕
2010年1月和5月,羅氏的Kadcyla和Seagen的Adcetris兩款ADC藥物相繼在國內獲批,開啓了中國ADC藥物商業化的元年。隨着全球ADC 藥物開發浪潮的迭起、ADC 藥物臨牀優勢的凸顯以及其巨大市場潛力的逐步兌現,國內藥企近幾年也紛紛佈局ADC賽道。2021年6月,榮昌生物針對HER2過表達局部晚期或轉移性胃癌的ADC藥物愛地希附條件獲批,成爲我國首個獲批上市的國產ADC藥物。目前,國內已有ADC產品相關臨牀申請超過30個,申報企業大體可以分爲三類:
(1)自主研發的創新型醫藥企業
近期在港股上市的榮昌生物是目前國內ADC藥物自主研發進度最爲領先的企業之一,其針對至少接受過2種系統化療的HER2過表達局部晚期或轉移性胃癌的ADC藥物愛地希已於2021年6月獲附條件批準上市。此外,美雅珂生物、多禧生物等創新藥企,因其領先的核心技術和豐富的ADC產品線,近年來也取得較快發展。
(2)自主研發的大型綜合藥企
上市藥企中,恆瑞醫藥、科倫製藥、石藥集團等憑藉自身較強的綜合研發實力,都已自主開發ADC藥物。恆瑞醫藥佈局的國內首個靶向c-Met的ADC藥物已進入I期臨牀;科倫藥業開發的靶向TROP-2的ADC藥物已獲得I期臨牀數據,與同類藥物相比具有“me-better”潛力;石藥集團自主研發的用於治療胃癌的ADC藥物已進入國內I期臨牀,並已獲得FDA孤兒藥資格認定。
(3)通過授權合作引進ADC的企業
ADC藥物研發難度大、週期長,對於具有資金實力的企業,引進優質產品管線是企業快速建立先發優勢的一種方式。例如,雲頂新耀以8.35億美元引進的lmmunomedics公司針對三陰乳腺癌的ADC藥物Trodelvy目前已在國內提交上市申請;齊魯製藥以3000萬美元引進的美國Sesen Bio公司針對膀胱癌的ADC藥物Vicineum目前已進入III期臨牀;華東醫藥以3億美元引進的ImmunoGen公司的卵巢癌ADC藥物在國內已進入I期臨牀;除此之外,三生製藥、復星醫藥、君實生物、基石藥業等也有各自引進的ADC管線。
從研發進展和技術成熟度來看,我國的ADC藥物起步較晚,與海外企業相比仍有較大差距,整體處於“fast follow”階段,國內管線在靶點和小分子藥物選擇上主要是跟隨海外藥企的成熟經驗。
表6 國內ADC藥物研發概況(不完全統計)
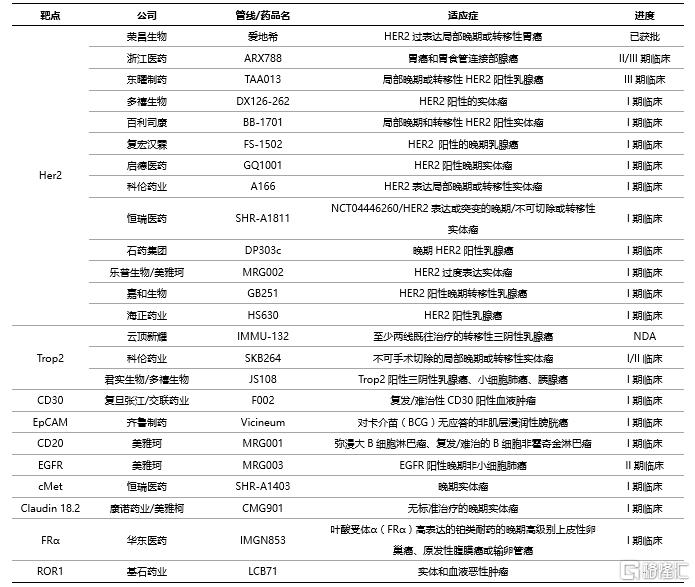
資料來源:國泰君安證券研究
從市場角度來看,首個國產ADC藥物的誕生,標誌着我國的ADC藥物市場從導入期進入成長初期。隨着ADC藥物不斷落地和適應症的持續延伸,國內的市場容量將不斷擴大。根據頭豹研究院預測,中國ADC藥物行業市場規模將由2020年的42億元增長至2024年的126億元人民幣,年均複合增長率高達31.6%。
圖19 中國ADC藥物市場規模預測
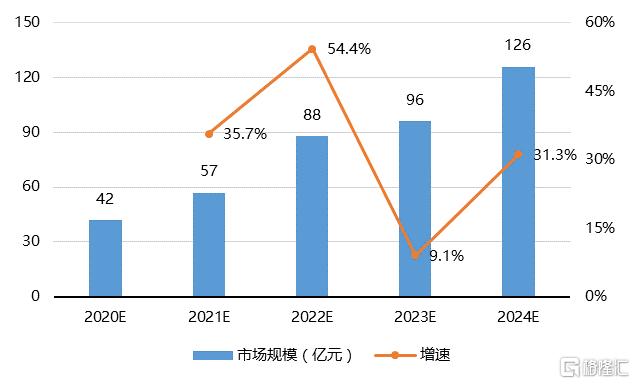
資料來源:頭豹研究院,國泰君安證券研究
四、ADC藥物發展趨勢
4.1
靶點開發助力ADC成爲腫瘤治療平臺型技術
根據ADC藥物的作用機理可知,其主要依靠小分子毒素髮揮藥理作用,靶點更多起到的是“定位”的作用,其特異性對於ADC藥物比較關鍵,而生物學效應並不十分重要。因此,ADC 藥物的靶點選擇範圍遠大於治療型抗體,在腫瘤表面過表達甚至腫瘤微環境中的特異性抗原均可以作爲潛在的ADC靶點。未來,越來越多新靶點被用於ADC藥物開發將持續擴大其可治療腫瘤的範圍。此外,從抗體角度來看,除了普通的單抗外,用於治療的雙特異性抗體、納米抗體也可用於ADC藥物的開發。例如,加拿大的Zymeworks公司開發的雙特異性抗體ADC藥物將Auristatin毒素偶聯至HER2雙抗,可同時特異性結合HER2受體的兩個非重疊表位,在臨牀前研究中對低表達HER2和高表達HER2乳腺癌模型均表現出較好的抗癌效果。總體來說,一方面,ADC藥物在抗癌方面具有更爲廣泛的靶點選擇;另一方面,ADC藥物可將目前用於腫瘤治療的單抗、雙抗、化學藥物等手段和技術結合在一起,充分發揮其各自優勢。因此,ADC有望成爲未來腫瘤治療的一項平臺型技術。
圖20 ADC藥物的靶點選擇範圍
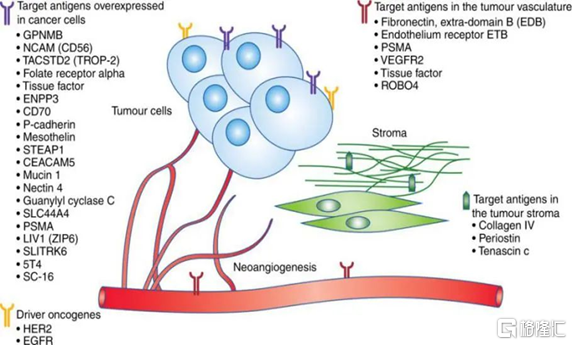
資料來源:Diamantis & Banerji
4.2
非癌適應症有望成爲ADC藥物的下一個藍海市場
目前已上市的ADC藥物均用於癌症治療,在研管線中絕大部分也是以惡性腫瘤爲適應症。但ADC作爲抗體、連接子和小分子毒素的組合型藥物,理論上具有非常多的組合可能,因此擁有很大的外延價值。如果將ADC技術視爲廣義的藥物傳遞工具,其所連接的小分子藥物可擴展至免疫調節劑、酶、多肽、小核酸等,其適應症則可相應地延伸到癌症之外的其他多個領域。近幾年,全球多家生物醫藥公司開始探索使用ADC治療腫瘤以外的適應症,包括眼科、免疫學、抗感染、內分泌/代謝等疾病領域。例如,美國Avidity公司與禮來(Lilly)公司達成合作,利用該公司的抗體偶聯寡核苷酸技術平臺開發治療免疫性疾病的創新療法,通過與抗體偶聯,可以將寡核苷酸藥物遞送到特定的組織中,並且可以避免使用脂質體遞送寡核苷酸導致的毒副作用。此外,艾伯維(AbbVie)開發的一款將靶向TNF的抗體與糖皮質激素受體調節劑偶聯形成的ADC藥物ABBV-3373已在針對類風溼性關節炎患者的IIa期臨牀試驗中表現出積極的結果,能夠在調節局部炎症反應的同時避免皮質類固醇的全身性副作用。通過對ADC研發管線佈局的分析也可發現,處於早期開發階段的ADC藥物中非癌適應症的比例明顯提高,這一趨勢也預示着非癌適應症可能成爲ADC藥物開發的下一片“藍海”。
圖21 不同研究階段ADC藥物的適應症分佈

資料來源:Cortellis,藥明康德
注:數據截至2020年7月14日
五、ADC藥物產業鏈中的投資邏輯
ADC藥物產業鏈的上遊爲研發型創新藥企業,憑藉其核心技術進行ADC藥物五大關鍵元素的設計,如羅氏、吉利德等,在整個產業鏈中處於主導地位,同時也處於價值鏈的頂端。產業鏈中遊爲CRO及CDMO企業,其主要爲上遊研發企業提供專業的 ADC 藥物工藝優化、藥物篩選、臨牀批生產、臨牀試驗和上市後的藥物生產等服務,是產業鏈中的關鍵一環。產業鏈下遊主要爲合同銷售組織、終端醫院、藥店等在藥物獲批上市後進行學術推廣、藥物銷售的企業或機構。
圖22 上遊研發企業主導ADC藥物產業鏈
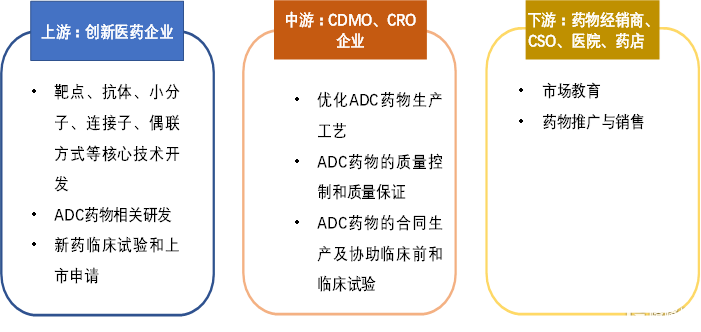
資料來源:國泰君安證券研究
5.1
上遊企業:關注其核心技術及差異化優勢
ADC藥物的研發包括單抗的生產和優化、接頭的選擇和連接、效應分子的選擇,這些過程涉及到了與生物藥、化學藥、基因工程相關的多項複雜技術,具有較高的技術壁壘。上遊企業若想在競爭日益激烈的ADC賽道中脫穎而出須具備兩個條件:
(1)領先的核心技術平臺
從技術層面來看,ADC的研發難度已經達到生物製品的高峯,涉及到ADC的設計、單抗的生產和優化、連接子的選擇和偶聯技術的創新。ADC藥物近百餘年的發展過程即是通過不斷的技術突破優化藥物穩定性、均一性、免疫原性的過程,例如,基因工程技術的突破實現了抗體的人源化、降低了ADC藥物的免疫原性,定點偶聯技術的誕生解決了ADC藥物均一性問題等。擁有核心技術的企業可在技術平臺上不斷開發新型ADC藥物,進而在該領域佔得先機,同時還能通過技術和專利授權獲取可觀收入。未來,技術和專利的挑戰很可能成爲ADC 領域新進入者所面臨的一大難題。
表7 擁有核心技術的企業處於行業領先地位
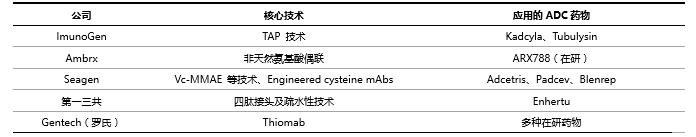
資料來源:國泰君安證券研究
(2)差異化優勢
國內的ADC藥物開發處於“fast follow”階段,從目前國內研發佈局來看,在靶點和適應症方面已經出現了簡單“跟隨”的苗頭,以HER2爲靶點、乳腺癌爲適應症的研發管線較爲集中。簡單“跟隨”對於具有先發優勢的企業較爲有利,但對於進度靠後的企業則價值有限,就算最終藥物研發成功也存在較大的商業化風險。例如,近幾年PD1/PDL-1單抗的簡單跟隨式研發導致該市場迅速成爲紅海,恆瑞、君實、信達、百濟神州四家率先獲批並進入醫保的企業幾乎佔據了國內絕大部分市場份額,後續企業將很難獲得理想收益。ADC作爲組合藥物,與其他藥物相比更容易做出差異化產品。一方面,企業可開發新的靶點或針對成熟靶點開發新的適應症,實現人無我有;另一方面,企業可憑藉其技術平臺,通過連接子、偶聯方式的優化,開發出同靶點、同適應症中有效性、安全性更高的me-better或me-best藥物,實現人有我優。由此,對於上遊企業來說,核心技術和差異化優勢是取勝關鍵,二者缺一不可。
圖23 我國臨牀階段ADC藥物的靶點研發分佈(不完全統計)(單位:個)
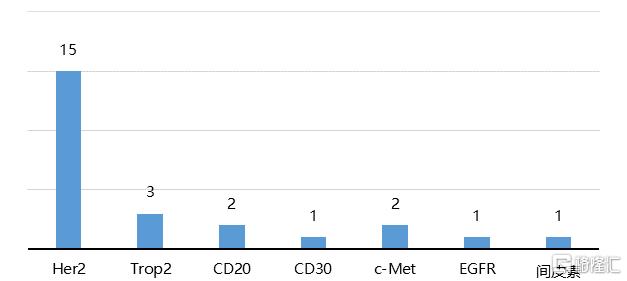
資料來源:火石創造,國泰君安證券研究
5.2
複雜工藝爲中遊CDMO企業帶來機遇
ADC 藥物結構特殊,藥理學及毒理學特徵複雜,且研發生產集合生物藥、化學藥相關的多項複雜工藝和分析技術。目前,ADC藥物在開發和生產過程中至少面臨四大挑戰:
(1)偶聯工藝的開發與優化
這一過程需要綜合考慮DAR、異質性(載藥量分佈)、遊離藥物清除等因素,從而確保產品的有效性和一致性。
(2)ADC製劑開發
單抗中間體和偶聯藥原液都需要開發製劑,對於單抗中間體制劑開發需要確保生產、儲存和使用過程中抗體的穩定性,不會對後續ADC生產造成影響;而對於ADC製劑開發需要平衡抗體、連接子-小分子毒素以及偶聯化學鍵的穩定性。
(3) ADC分析方法開發和產品表徵
ADC生產過程中偶聯過程和結果、連接子-小分子毒素及ADC藥物的穩定性等各類生物化學過程以及中間體、最終產物的分析均具有一定挑戰性,ADC藥物分析的工作量往往是普通單抗藥物的兩倍以上。
(4)複雜的供應鏈
生產抗體、連接子、偶聯藥原液和製劑往往需要多個生產基地,研發企業很難同時兼具單克隆抗體、連接子以及偶聯藥原液和製劑的生產能力。
上述挑戰使得目前70-80%的ADC藥物開發生產會採用CDMO的形式進行。ADC藥物的爆發式發展也爲中遊的研發和生產服務商帶來了發展機遇。同時,ADC藥物生產的技術難度也對CDMO企業提出了較高的技術要求,國內目前僅有藥明生物、邁百瑞等少數幾家CDMO企業具有承接ADC藥物生產的能力。
六、 總結與觀點
ADC藥物在經歷了早期開發階段的曲折道路之後,伴隨着不斷的技術突破,近年來不論是從獲批藥物數量還是從在研藥物以及適應症的擴展速度來看,都呈現了爆發式增長的趨勢。ADC藥物的特殊結構和作用機理使其具備非常高的延伸性,未來除了能夠進一步擴大腫瘤適應症外,非癌領域也有望成爲ADC藥物的下一片藍海市場。而同樣需要看到的是,儘管經歷了三代藥物的發展歷程,ADC藥物還是面臨着脫靶、毒副作用、穩定性等方面問題。未來,通過新靶點和小分子毒素的開發、連接子設計和偶聯技術的優化進一步加強ADC藥物的特異性和治療效率、擴大治療窗口仍是ADC藥物的技術突破方向。
從投資的角度分析,由於ADC 藥物具有非常高的技術壁壘,進入該領域的企業很可能選擇已經成熟的靶點、小分子和適應症入手,而造成同類產品扎堆、競爭加劇。因此,企業的核心技術和產品的差異化優勢是取勝的關鍵,產品設計理念和技術平臺是投資標的篩選時的關注重點。與此同時,ADC藥物的快速發展所產生的研發生產需求也將爲CDMO行業帶來機遇,技術實力和資源整合能力強的研發生產外包服務商值得重視。
表8 ADC藥物研發領域代表性企業





