8月12日,東曜藥業發佈2021年上半年財報,營業收入同比增長78%,為2313.2萬元,得益於公司積極拓展CDMO/CMO業務,相關收入同比大幅增長330%。此外,公司上半年研發費用為8874.9萬元,銷售費用為1120.2萬元。依附於公司CDMO業務增長,東曜藥業進入業績收穫的一年。由此可以看出,東曜藥業選擇在ADC火熱之時,切入CDMO賽道是一個正確的決策。
作為國內較早佈局ADC賽道的東曜藥業,此前曾宣佈與博瑞醫藥建立夥伴關係,開展ADC的CDMO服務戰略合作,正式跨入CDMO賽道。那麼這家在ADC研發上處於第一梯隊的創新藥企,在CDMO領域上能否脱穎而出?
ADC藍海之下,CDMO前景無限
伴隨着國產ADC藥物的獲批上市,ADC賽道的競爭已經開啟新篇章。創新藥企從早期注重研發,到如今佈局大規模商業化生產。然而由於ADC藥物的高門檻,形成完善的商業化生產能力並非一朝一夕。因此,針對ADC藥物的CDMO需求應運而生。
ADC藥物主要用於抗腫瘤領域,由抗體、細胞毒藥物、連接子三部分組成。因為ADC藥物靶點清楚及選擇性好,其出現填補了抗體藥物和傳統化療藥物之間的空白,提高了藥物的特異性並改善了治療窗口。
2000年輝瑞的全球首款ADC藥物Mylotarg上市,不過由於當時各種技術有限以及安全性不穩定,於2010年退市,導致ADC賽道進入了停滯階段。但是隨着技術的進步,Adcetris和Kadcyla藥物於2011年和2013年先後研發成功上市,使得ADC藥物重新迴歸大眾視野,有了藥物成功上市的先例,大量的創新藥企業開始湧入ADC藥物研發賽道,奠定了未來抗癌藥物的發展趨勢。
根據IQVIA數據顯示,目前全球已有13款ADC藥物上市,雖然現在ADC藥物市場主要還是由歐美企業佔據,但國內也已有許多企業開始緊跟其後步入研發,比如榮昌生物的維迪西妥單抗作為首個國產ADC藥物也於上個月獲批上市。截止於目前,全球披露的已立項的ADC項目已達339個,而中國公司已立項的的ADC項目有104個。
截止於2021年3月,Nature Reviews Drug Discovery對已批准上市的10個ADC藥物進行了銷售預測,預計2026年市場規模將超過164億美元。由此可以看出未來ADC藥物市場潛力巨大,一片藍海。
圖表一:10款ADC藥物銷售額預測

數據來源:Nature Reviews Drug Discovery,格隆彙整理
由於ADC藥物生產有着非常高的技術壁壘,整套流程下來對技術、工藝、場地等各個環節的合規性要求都極高。當前國內許多企業會選擇自己完成生物偶聯到最後的製劑灌裝,然後將抗體、毒素和連接子這些生產工作交由外部工廠完成,或者有些公司會選擇將生產工作全部外包。
而國內現在滿足這些要求的CDMO企業寥寥無幾,導致產能不足。因此在需求的推動下,CDMO行業迎來高速發展的趨勢。根據Frost&Sullivan數據顯示,現在國內主要以小分子CDMO業務為主導,其行業規模2019年為437億元,預計2023年將增長至635億元。國內大分子CDMO行業還處於起步階段,但是預計2018年至2023年年複合增長率高達40%,處於高速發展的階段。
處於ADC藥物研發第一梯隊的東曜藥業,公司CEO劉軍博士認為,目前公司的條件非常符合當下市場對CDMO業務的需求,公司從做化藥、生物藥到自主研發創新藥的過程所積累下來的經驗完全可以與其他創新藥公司分享,互相協作利於快速實現公司價值。
在2016年底,由蘇州園區牽線,促成了東曜藥業與開拓藥業合作,開始走上了發展CDMO業務的道路。目前,公司還支持開拓藥業在海外多地的新冠適應症的臨牀試驗。
除此之外,東曜藥業與博瑞醫藥於今年7月簽訂合作協議,開展ADC的CDMO服務戰略合作,共同為客户提供ADC產品前期工藝開發、中間體規模放大和GMP生產服務,進一步加強公司CDMO的服務能力。通過技術和資源互補,加速國內創新藥的研發與商業化。值得注意的是,兩家公司皆為蘇州園區內的上市公司,距離不超過10公里,因此這次合作不僅實現了產業鏈的無縫銜接,還能避免跨區域監管的風險。
同時,公司還與海外公司進行CDMO合作,例如向Y Project供應COVID-19臨牀樣品,與Miracogen合作提供ADC藥物的CDMO生產服務。
競爭優勢:技術+商業化生產能力
為什麼東曜藥業不僅可以做到自主研發ADC藥物,還能與國內外製藥公司開展多元化CDMO合作,這取決於公司優秀的的研發及生產能力。
目前東曜藥業在研產品共有12個,包括單抗藥物如TAB008(抗VEGF)、TAB014(抗VEGF)、TAY018(抗CD47)以及ADC藥物,如TAA013(抗HER2)等產品,覆蓋多項高發癌症適應症。
在研發技術上,公司上半年產品研發進度加快。其中公司首個自主研發的化藥TOZ309(替莫唑胺膠囊)已於5月獲批國內上市,主要針對治療新診斷及複發性腦膠質瘤和複發性間變性星形細胞瘤。
並且今年7月初,東曜藥業就ADC產品TAA013的III期臨牀數據進行了線上及線下的交流與討論,數據表明TAA013在治療HER2陽性乳腺癌中表現出了良好的安全性及藥效性。根據資料顯示,TAA013是目前中國市場上以T-DM1作為通用名稱進度最快的ADC產品。公司預計2022年底完成其III期臨牀並於2023年進行商業化銷售。
圖表二:公司最新產品管線及研發進度
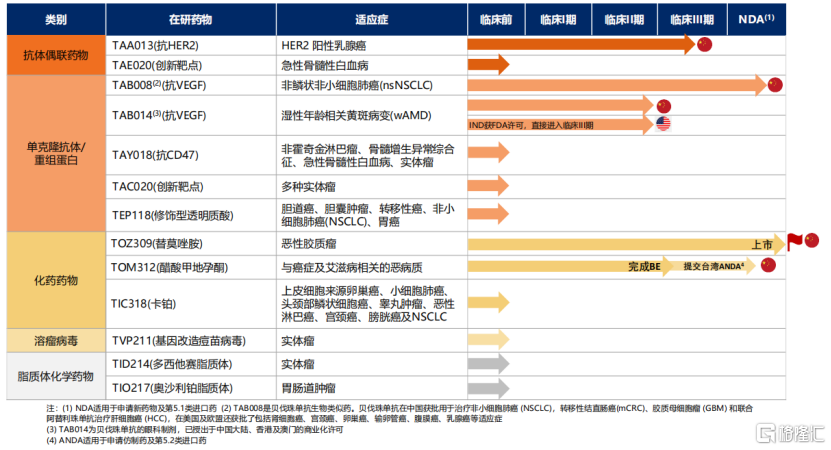
數據來源:公司2021年上半年業績報吿,格隆彙整理
此外,相比於其他ADC藥物公司,東曜藥業的優勢在於其擁有自主研發的三個平台:
(1)治療性單抗及ADC藥物技術平台。該平台具有篩選細胞克隆及構建細胞庫到化學、CMC開發、擴大生產、填充以及包裝等各種功能,目的是為了儘量發揮抗體藥物的協同效應,進一步開發ADC產品。
(2)以基因工程為基礎的治療技術平台。該平台整合了抗腫瘤免疫療法、基因療法及病毒療法,可以充當腫瘤靶點,重組腫瘤病毒載體系統的研發及生產。目前公司已開發基於痘苗病毒的腫瘤藥物,並繼續憑藉此藥物進行平台驗證。
(3)創新型藥物技術平台。公司通過該平台開發先進的靶向性脂質體藥物傳遞系統,具備無菌凍乾和無菌灌裝生產能力。
公司的三大技術平台涵蓋了ADC藥物生產的整個流程,真正做到了集ADC藥物生產全產業鏈為一體的公司。
在商業化生產上,東曜藥業擁有國內少有的符合GMP標準的集單抗+ADC原液和製劑生產一體的ADC商業化生產車間。在蘇州工業園擁有佔地面積 50000 平方米的生產基地,一號廠房在2012年已竣工,配備了單抗中試車間、OEB-5級別的ADC中試車間以及 BSL-2 認證病毒車間、符合 GMP 標準的小分子藥物口服和針劑車間。並且公司在2018年建成了具有國際標準的生物藥單抗藥物大規模生產車間,設計產能達16000升。2020年ADC藥物原液車間已經建設完成投入使用,並同步規劃ADC製劑車間,為商業化發展奠定基礎,持續加大對外合作。
小結
隨着現在創新藥的研發越來越強調質量和速度,國際及國內CDMO市場需求激增,產業資源匱乏,東曜藥業作為一家擁有ADC藥物全產業鏈平台的公司,擁有自主開發的三大技術平台,憑藉其自身的研發技術及商業化生產優勢,在CDMO領域佔據頭部地位。
此外,浦銀國際發佈研報認為CDMO賽道未來將會快速發展,並且認為東曜藥業的CDMO業務好於其預期。公司自2016年起與開拓藥業進行CDMO合作,同時現在在美國進行治療新冠病症的III期臨牀,其預計公司今年的CDMO業務將會對收入大有貢獻,值得長期關注與期待。




