擁有12款抗腫瘤藥物的德琪醫藥(Antengene Corporation Limited)(6996.HK)於今天啟動招股,招股區間為15.8港元/股—18.08港元/股,每手500股,一手入場費9131.09港元,高盛和摩根大通作為其聯合保薦機構,預計將於11月20日掛牌上市。
據招股書披露,德琪醫藥本次IPO引入10名基石投資者,包括富達、GIC(新加坡政府投資公司)、貝萊德、博裕、Cormorant、高瓴、紅杉資本、CRF Investment、Laurion Capital及Octagon Investments等醫療健康行業知名機構投資者,合共投資金額1.79億美元。
超20家明星機構參與上市前融資
德琪醫藥自成立以來,在國際資本市場備受青睞。在此次IPO前,德琪醫藥已經融到C輪,共計融資金額2.39億美元,摺合人民幣約16.34億元。
從投資方來看,投資方的陣容十分強大。一方面,公司獲得了諸多同業公司的青睞。早在德琪醫藥A輪融資中,就已經吸引泰格醫藥(300347.SZ)、新基中國的投資,在B輪融資中則是吸引了藥明康德(603259.SH)、啟明創投的加碼。
另一方面,公司也得到了全球諸多PE/VC機構的支持。其中既有善於全球佈局尋找優質標的的基金管理公司,也有擅長投資醫療大健康領域的投資機構,例如富達、貝萊德、GIC、博裕資本、高瓴資本、方源資本、國新國信東吳海外基金、泰康資管等機構。而其中富達、貝萊德、GIC、博裕、高瓴也作為基石投資者參與了本次IPO,足見機構投資者對公司的前景充滿信心。
圖表一:德琪醫藥融資情況

數據來源:公司公告,格隆彙整理
在研產品管線強大,手握小分子抑制劑以及單雙抗王牌
從過往尋求上市的生物科技類公司來看,能夠在過往的融資中同時吸引超過20家明星創投公司融資,這是十分少見的。那麼,公司到底有什麼樣的魅力?且來看公司的核心產品。
對於一家18A生物科技類公司,在研產品就是公司的命脈,德琪醫藥的在研產品主要是依靠小分子抑制劑以及雙抗產品來打天下。
從在研產品管線上來看,公司共計擁有12種用於治療腫瘤的在研產品,其中包括2種晚期臨牀資產、4種早期臨牀資產和6種臨牀前資產。截止公司招股書披露,目前公司有9項正在進行臨牀試驗,5項計劃啟動臨牀試驗,並在亞太多地區收到9項IND批准。
圖表二:在研產品管線

數據來源:公司公告,格隆彙整理
● ATG-010(selinexor): 同類首款且唯一的一種抑制XPO1的SINE化合物,美國地區已上市
ATG-010(selinexor)是一款選擇性核輸出抑制劑(selective inhibitor of nuclear export, SINE),是全球首創且唯一一種抑制核輸出蛋白XPO1的SINE口服抗癌藥物。
核輸出蛋白1(exportin 1, XPO1),是karyopherin-β家族最重要的出核轉運受體之一,負責超過240種蛋白的出核轉運。在特定的腫瘤細胞中,XPO1過量表達,並導致多種抗凋亡蛋白髮生亞細胞定位及功能的紊亂,從而抑制腫瘤細胞的凋亡進程,促進腫瘤的發生發展。XPO1作為抗癌治療的潛在靶標,通過抑制XPO1的出核轉運過程,阻止抗凋亡蛋白的過度出核轉運,從而保持核內有效濃度併發揮抑癌作用。
圖表三:XPO1介導的蛋白出核轉運機制
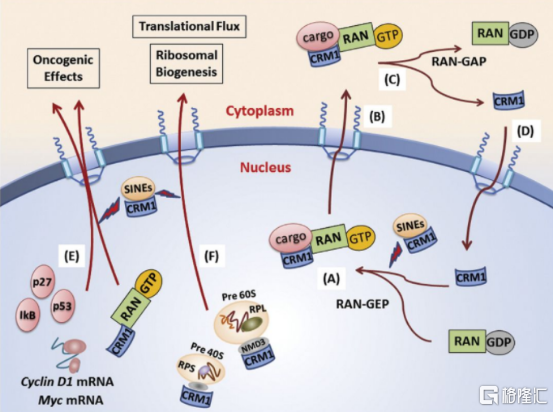
數據來源:公開資料,格隆彙整理
目前僅有1款可作用於XPO1靶點的藥物獲批上市。ATG-010(selinexor)是第一款也是唯一一款被FDA批准可同時用於治療復發/難治多發性骨髓瘤及復發/難治性瀰漫性大B細胞淋巴瘤的藥物,也是獲FDA批准唯一一種治療復發/難治性瀰漫性大B細胞淋巴瘤的單一藥物及口服藥物。
多發性骨髓瘤,是全球第二常見的血液系統惡性腫瘤,在老年患者中十分常見。根據Frost&Sullivan數據統計顯示,中國多發性骨髓瘤的復發/難治性發病例2019達到68200例,預計到2024年增至127600例,年複合增長率為13.3%。而在治療藥物的市場規模上,受到發病率及患病率上升所推動,中國多發性骨髓瘤藥物市場在2015年至2019年以41.2%的年複合增長速度增長,2019年達到57億元,預計2030年將達到267億元市場規模。
圖表四: 中國多發性骨髓瘤藥物市場規模

數據來源:Frost&Sullivan,格隆彙整理
從當前的競爭情況來看,目前中國共計有4個靶向治療候選藥物及一款細胞治療候選藥物正在進行多發性骨髓瘤的臨牀II期或III期開發。相較於其他產品,例如CAR-T治療可能存在患者對T細胞疲勞導致末線治療會產生不利影響,XPO1抑制劑具有不依賴T細胞活化的新型作用製劑,可以為患者提供更多選擇。目前,僅有ATG-010(selinexor)為通過XPO1抑制劑進行治療,在中國處於臨牀II期試驗,有望成為治療多發性骨髓瘤的主要方式。
圖表五:正在研發階段用於治療多發性骨髓瘤的藥物情況

數據來源:公司公告,格隆彙整理
瀰漫性大B細胞淋巴瘤,是最為常見的非霍奇金氏淋巴瘤的類型,2019年中國患瀰漫性大B細胞淋巴瘤人數達到199100人,預計到2030年將達到299300人。然而在針對復發/難治性瀰漫性大B細胞淋巴瘤,卻缺乏有效的治療方案。ATG-010(selinexor)是目前用於治療復發/難治性瀰漫性大B細胞淋巴瘤患者的唯一可用口服療法,已獲得美國FDA批准,在中國處於臨牀II期試驗。
除了可以用於治療復發/難治性多發性骨髓瘤及復發/難治性瀰漫性大B細胞淋巴瘤外,ATG-010(selinexor)還在研究針對其他腫瘤疾病(包括實體瘤和血液系統惡性腫瘤)的抗癌潛力,並計劃向不同地區提交NDA申請,其中包括:
1.Karyopharm在美國進行鍼對數種適應症(包括脂肪肉瘤、複發性腦膠質瘤及子宮內膜癌)的後期臨牀試驗;
2.在中國結合ICE/GRMOX開展針對復發/難治性外圍T細胞和NK/T細胞淋巴瘤的臨牀Ib試驗;
3.在中國進行鍼對治療KRAS突變非小細胞肺癌的臨牀II期試驗;
4.在中國同時提交關於復發/難治性多發骨髓瘤和復發/難治性瀰漫性大B細胞淋巴瘤的NDA;
5.Karyopharm進行臨牀試驗所得數據作為基礎,徳琪醫藥計劃在2021年前直接向特定亞太國家或地區(包括澳大利亞、新加坡、香港、韓國、台灣及泰國)遞交ATG-010(selinexor)的NDA。
● ATG-016(eltanexor):第二代口服SINE化合物,臨牀I/II期
相比起第一代的ATG-010,ATG-016(eltanexor)作為第二代口服SINE化合物,在治療的動物中可以出現較低的體重減輕並改善食慾。
目前,ATG-016(eltanexor)正在針對多種癌症類型進行研究,最快已經進入臨牀I/II期,包括:(1)高風險骨髓增生異常綜合症(HR-MDS);(2)轉移性結腸直腸癌(mCRC);(3)轉移性去勢抵抗性前列腺癌(mCPRC)及其他類型晚期癌症。
此外,公司計劃多項針對ATG-016(eltanexor)的臨牀試驗,其中包括:(1)在中國入組含去甲基化藥物的療法治療失敗的高風險骨髓增生異常綜合症的開放標籤、單臂I/II臨牀試驗(HATCH試驗),已於2020年8月向國家藥監局提交IND申請,預計將在2021上半年獲IND批准進行給藥;(2)預計2021年前提交用於治療KRAS突變實體瘤的臨牀試驗申請;(3)預計2021年前提交用於治療胃癌的臨牀試驗申請;(4)預計2021年前提交用於治療三陰性乳腺癌的臨牀試驗申請。
● ATG--527(verdinexor):非腫瘤領域的第三種SINE產品,2020Q4提交IND申請
作為公司研發管線的第三種SINE產品,ATG--527(verdinexor)主要在非腫瘤領域進行研發探索。
在臨牀前的研究表明,ATG--527(verdinexor)具有廣譜抗病毒活性,包括抵抗大流行性流感病毒株和其他病毒腫瘤,例如人類免疫缺陷病毒(HIV)、呼吸道合胞病毒(RSV)、丙型肝炎病毒(HCV)及EBV。此外,公司在治療系統性紅斑狼瘡(SLE)上進展前景良好,2019年中國系統性紅斑狼瘡市場規模達到16億元。
根據公司的規劃,預計將在2020年第四季度在中國進行鍼對慢性活動性EB病毒感染(CAEBV)的IND申請,並有望開展一項治療系統性紅斑狼瘡的臨牀試驗,從而擴大ATG-527的適應症範圍。
● ATG-008(onatasertib): 同類首款第二代口服雙靶點的mTORC1/2抑制劑,臨牀I/II期
ATG-008(onatasertib)是一款有潛力成為同類首款的第二代口服雙靶點的mTORC1/2抑制劑,主要用於治療各種晚期實體瘤及血液系統惡性腫瘤。
mTOR是一種調節細胞生制、代謝、增殖和存活的絲氨酸/蘇氨酸激酶,在許多癌症中經常發生mTORC信號過度激活。從臨牀前研究結果上來看,ATG-008可以有效抑制mTOR激酶,並能夠克服傳統的mTORC1抑制劑的缺點。
圖表六:ATG-008作用機制

數據來源:公司資料,格隆彙整理
目前,公司正在開展針對晚期實體瘤(包括肝細胞癌及NFE2L2突變非小細胞肺癌)的單藥或與免疫檢查點抑制劑拓益(特瑞普利單抗)聯合用藥的研究。在公司規劃上,公司計劃在中國開展ATG-010聯用ATG-008的I/II期臨牀試驗,用於治療復發/難治性瀰漫性大B細胞淋巴瘤。另外,公司已在2020年7月獲得國家藥監局臨牀II期籃式試驗的IND批准,來評估ATG-008在實體瘤上的療效,計劃在2020年第四季度進行患者招募。
德琪醫藥的產品組合在行業內具備充分的競爭力,亦有賴於一支資深的研發團隊。德琪醫藥創始人梅建明博士曾擔任新基(Celgene)的臨牀研發主管,是全球最暢銷腫瘤治療藥物瑞復美臨牀開發的領導成員之一,並參與了另一款暢銷腫瘤藥物POMALYST及用於治療急性髓性白血病的首創新藥IDHIFA的臨牀開發。除梅博士外,研發團隊成員在不同類型淋巴瘤、白血病和多發性骨髓瘤的藥物方面具備豐富的臨牀研發經驗。這樣一支團隊,不但有助於推進現有產品組合的研發進度,也為今後不斷擴充產品組合提供了新鮮血液。
生產+銷售兩手抓,商業化籌備工作進展順利
其實看公司的在研產品的研發進度,核心產品其實距離商業化近在咫尺,那麼公司的商業化籌備工作如何了?
從生產線上來看,公司在研發階段主要通過委託CDMO公司來確保生產。而為了籌備ATG-010的近期上市,公司已經在中國紹興建立約16300平方米的製造工廠,從而提升公司的自身生產能力以及生產候選藥物。
按照公司的規劃,預計在2020年年底之前,將為ATG-010建立一條符合GMP標準的包裝生產線,並在2021年前在紹興製造工程建立一條符合GMP標準的用於固體劑量藥品的試點及生產線,未來將幫助公司其他候選藥物的上市以及商業化。此外,公司預計2022年將完成國家藥監局食品藥品審核查驗中心的現場核查。
值得關注的是,在今年10月,德琪醫藥與藥明生物正式簽署戰略合作備忘錄,兩者將在新藥開發和生產方面全方位合作,共同推進抗腫瘤創新藥領域的研發。此次與藥明生物的合作,將加快公司在腫瘤領域同類首創及同類最優的創新療法的研發進程,也將有利於提升公司在生物製藥生產技術能力。
而在銷售上,公司已經建立商業化團隊,並計劃ATG-010在國家藥監局以及其他市場獲批後,進一步擴大團隊。其中,計劃ATG-010在中國上市後1-2年內,擁有一支100名的銷售團隊,在ATG-010進入國家醫保目錄後,將團隊擴大到150-200人。針對其他亞太市場,公司計劃2021年建立一支50人的商業化團隊。
值得注意的是,德琪醫藥首席商務官、負責市場戰略監督的John Chin,與創始人梅建明博士同樣曾任職於新基,支持新基產品在中國的開發、審批及商業化,並在瑞復美的上市中扮演關鍵角色。兩位研發及商業化團隊的核心領導人物組成的黃金搭檔,擁有合作打造瑞復美的成功經驗,也為德琪醫藥未來的商業化增加不少保障。此外,公司在中國區及其他亞太地區的商業化團隊也是由全球跨國公司以及國內公司在血液以及腫瘤產品方面具有豐富經驗的資深人士組建而成,這無疑對於推動公司未來的商業化進程至關重要。
小結
長久以來,中國的許多治療藥物尤其是癌症領域的治療,主要依賴進口藥物。做中國自己的抗癌藥,滿足普通患者的需求,正是國內創新藥企努力的方向。德琪醫藥作為亞太地區專注於創新抗腫瘤領域的生物製藥公司,也在通過研發全球同類首款、同類唯一/同類最優療法,為患者帶來福音。
此次公司上市,高盛和摩根大通作為保薦機構,引入10家基石投資者,加上超過20家PE/VC投資機構參與之前融資,都可以看出,無論是具備獨特性的核心產品組合、還是經驗豐富的研發及商業化團隊,均為公司打下了良好的基礎。伴隨着核心產品有望於短期內在中國獲批上市,德琪醫藥未來的商業化前景值得關注與期待。


