12月20日,石藥集團(1093.HK)公告指出,其自主研發的創新藥,馬來酸左旋氨氯地平片CONJUPRI®(中國上市名:玄寧),通過美國食品藥品監督管理局(FDA)新藥上市申請(NDA),用於治療高血壓。
這是中國醫藥企業率先向美國FDA遞交新藥上市申請,經過FDA正常審批途徑,中國本土企業首個獲FDA完全批准,且不需額外開展其他臨牀試驗的創新藥。
慢性病市場仍未飽和
2017年11月13日,美國心臟病協會等組織聯合發佈了新版高血壓指南,將原先的血壓值超過140/90mmHg,拓寬為超過130/80mmHg。按照新指南,美國將有一半人口成為高血壓患者,比例上升到近46%。
伴隨着患者基數不斷擴大,正在刺激高血壓市場的不斷擴容。據 QYResearch 數據顯示,2010年全球抗高血壓藥品規模達到300億美金,2016年模達到323億美金,年複合增速為1.2%,預測到了2022年,全球抗高血壓藥物的市場規模將達到350億美金。
而在我國,高血壓等慢病患病規模和死亡率不可小覷。《中國心血管病報告2018》顯示,我國心血管病患病率仍處於上升階段,目前患病人數約為2.9億,高血壓高達2.45億人,高血壓正是心臟病和中風的第二大誘因。
圖表一:心血管疾病死亡率
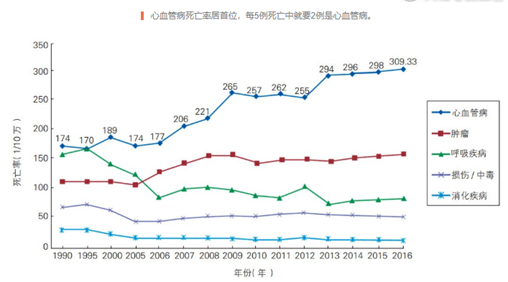
數據來源:《中國心血管病報告2018》,格隆彙整理
2019年11月,國家醫保局、財政部、國家衞生健康委、國家藥監局下發《關於完善城鄉居民高血壓糖尿病門診用藥保障機制的指導意見》,對繳納了城鄉居民基本醫療保險費的高血壓、糖尿病參保患者門診發生的降血壓、降血糖藥品費用由醫保統籌基金支付,政策範圍內支付比例要達到50%以上。
根據PDB數據統計顯示,慢性病市場仍未飽和,高血壓用藥在整個心腦血管用藥市場中佔比逐步提高。從樣本醫院的用藥市場規模來看,心血管系統用藥規模達到219.1億元,其中高血壓用藥規模達到76.8億元,佔比35%,並且仍有進一步增長趨勢。
圖表二:我國樣本醫院心血管系統用藥市場規模

數據來源:PDB,格隆彙整理
零的突破:中國本土新藥首獲FDA完全批准上市
雖然我國為高血壓患病高發地區,但是目前抗高血壓藥物市場仍以外資企業為主。此次石藥的高血壓產品玄寧獲得美國FDA批准上市,成為中國首家通過完全批准在美上市的企業,預計將會帶來美國的銷售以及中國銷量的進一步增長。
石藥集團玄寧在CCB藥物中佔比逐步提升
從市場規模上來看,目前我國常用的一線降壓藥主要有:
(1)利尿類;
(2)β-受體阻滯劑
(3)血管緊張素轉換酶抑制劑(ACEI)
(4)血管緊張素II受體阻滯劑(ARB)
(5)鈣拮抗劑(鈣通道阻滯劑,CCB)等五大類
其中鈣拮抗劑(CCB)藥物佔比最大,是我國最主要的抗壓藥物。在鈣拮抗劑藥物中,氨氯地平作由輝瑞首先開發的第三代鈣通道拮抗劑,成為市場份額最高且較為穩定。根據公開數據統計顯示,2018年中國公立醫療機構終端氨氯地平銷售額為63.76億元,佔據市場份額第一。玄寧(馬來酸左旋氨氯地平)的銷量和市場佔比不斷上升,由2012年的23.6%上升到 2018 年1季度的27.4%。
玄寧與同類藥品相比具有差異性優勢
相比起同類藥品,玄寧在臨牀用藥效果上,具有差異性優勢。
2013-2017年,國家十二五重大新藥科技重大專項LEADER研究—馬來酸左旋氨氯地平與苯磺酸氨氯地平在高血壓治療中的比較效果研究,由北京大學第一醫院霍勇教授牽頭,項目樣本量高達10000 餘例,覆蓋全國21 座城市,包括北京大學第一醫院、中國醫學科學院阜外心血管病醫院、上海交通大學附屬瑞金醫院等110 個臨牀參研中心。對LEADER研究最核心的評價指標—複合心腦血管事件的評判,亦採用了獨立的終點事件評審委員會盲審的方式進行。
研究結果顯示,玄寧相較於同類氨氯地平產品擁有以下產品優勢:
(1)療效確切。玄寧能夠在療效相同的情況下,劑量減半,使得血壓有效達標,療效確切。馬來酸左旋氨氯地平一半劑量的降壓療效與苯磺酸氨氯地平相當,馬來酸左旋氨氯地平血壓控制率94.24%,苯磺酸氨氯地平(進口)91.35%;對高血壓患者心腦血管複合終點事件的預防能力相當,馬來酸左旋氨氯地平復合心腦血管累計發生率4.57%,苯磺酸氨氯地平(進口)5.04%。
(2)藥物安全。玄寧不良反應少,藥物更安全,對於複合心腦血管終點具有更強的預防性。在不良反應方面,馬來酸左旋氨氯地平明顯優於苯磺酸氨氯地平(進口),尤其是水腫及頭痛方面表現更加突出,馬來酸左旋氨氯地平水腫發生率1.1%,頭痛0.7%,苯磺酸氨氯地平(進口)水腫發生率2.8%,頭痛1.1%。
(3)分子長效。玄寧是真正分子長效降壓藥,平穩降壓減少血壓波動,延緩動脈粥樣硬化進展。
(4)更多保護。玄寧可以掰開和研碎,自由調整服藥劑量沒有絕對的禁忌症,迄今為止無藥物相互作用報道,並且具有明確的心腦腎靶器官保護,是聯合用藥的首選。
LEADER研究的開展及後續詳細的數據分析,在中國高血壓藥物研究史上具有里程碑式的意義。
基於馬來酸左旋氨氯地平以上臨牀數據,美國FDA審核,同意通過在美國的橋接臨牀,以NDA申報,馬來酸左旋氨氯地平成為我國第一個向美國遞交NDA的產品。
創新藥“走出去”
截至發稿日為止,美國FDA的藥物評估與研究中心(CDER)已經批准了43款創新藥,雖然相較於去年新藥批准數目有所下降,但仍處於較高水平。
細看批准項目,競爭格局已然發生變化,美國市場不再是隻賣美國本土藥,中國藥企開始帶領創新藥“走出去”。
11月14日,百濟神州開發的布魯頓酪氨酸激酶抑制劑Brukinsa獲得FDA加速批准,治療套細胞淋巴瘤患者,這是獲得FDA批准的首箇中國原研抗癌藥。
12月20日,石藥集團研發的玄寧(馬來酸左旋氨氯地平)獲得FDA完全批准,治療高血壓,這是獲得FDA批准的首箇中國原研高血壓藥。
圖表三:FDA批准新藥數目
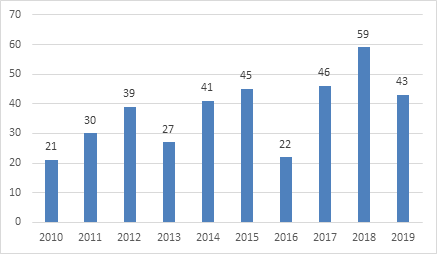
數據來源:藥明康德,格隆彙整理
實際上,從公司的發展路徑上來看,石藥集團早已在海外市場上進行佈局,帶領創新藥“走出去”。
2006年,石藥集團已經與美國藥企簽署關於丁苯酞軟膠囊在歐美市場的專利使用權轉讓協議,這是我國原創藥物首次向歐美髮達國家實現專利轉讓。作為全球首個專門治療腦中風的創新藥物,目前,丁苯酞已在美國30多家醫療機構開展臨牀II期試驗。
從研發項目上來看,截至發稿日數據統計顯示,石藥集團已經有8個品種在海外進行臨牀研究,5個產品取得美國孤兒藥以及兒童罕見病資格認定。
圖表四:在美孤兒藥品種

數據來源:公司公告,格隆彙整理
從研發策略上來看,公司已經在美國加利福尼亞、德克薩斯、新澤西等地建立了研發中心和臨牀中心,主要進行抗體藥物新靶點的篩選和研究、抗體藥物的細胞株構建和工藝技術開發、抗體定點偶聯技術及ADC藥物開發、CAR-T、幹細胞等免疫治療技術研究。
石藥在美國的 AlaMab 公司,聚焦於同類首創生物藥(First-in-Class) ,其中,全球同類首創(First-in-class)Cx43靶點抑制性抗體, 開始Ⅰ期臨牀試驗,全球同類首創(First-in-class)Cx43靶點激動性抗體, 即將開始Ⅰ期臨牀試驗。
根據公司披露,預計在2020-2022年石藥集團將有14個大分子創新藥獲得臨牀許可或申報IND,17個小分子創新藥獲得臨牀許可或申報IND。
小結
從玄寧的過往國內銷售情況來看,近年來玄寧維持高增長,2013年到2017年複合增長率達到27%。根據公司的規劃,將進一步有望通過大力開展學術推廣,逐步提升玄寧市佔率,逐步替代苯磺酸氨氯地平片。
此次玄寧能夠成功在美國獲批上市,將進一步對國內外銷售產生貢獻,有望成為未來高增長的大品種。
在醫藥政策頻發之際,傳統藥企的發展之路,將不僅僅是將國外好的藥品“引進來”,也就是我們説的license-in 方式,更需要將創新藥“走出去”,與國際標準接軌。而在國際化當中,能夠擁有先發優勢獲得FDA批准,結合本土的市場應用,或許能夠獲得更大的市場紅利,石藥集團值得繼續關注。




