作者:玉見
來源:醫藥魔方
從2018年下半年開始,雙特異性抗體的熱潮席捲全球,也激發了國內資本對“雙抗”的追捧,多家雙抗公司宣佈完成新一輪融資。在二級資本市場,2019年向港交所遞交IPO申請的10家未盈利創新藥企業中,也有2家企業有非常鮮明的“雙抗”標籤。
2019年向港交所遞交IPO申請的創新藥企業
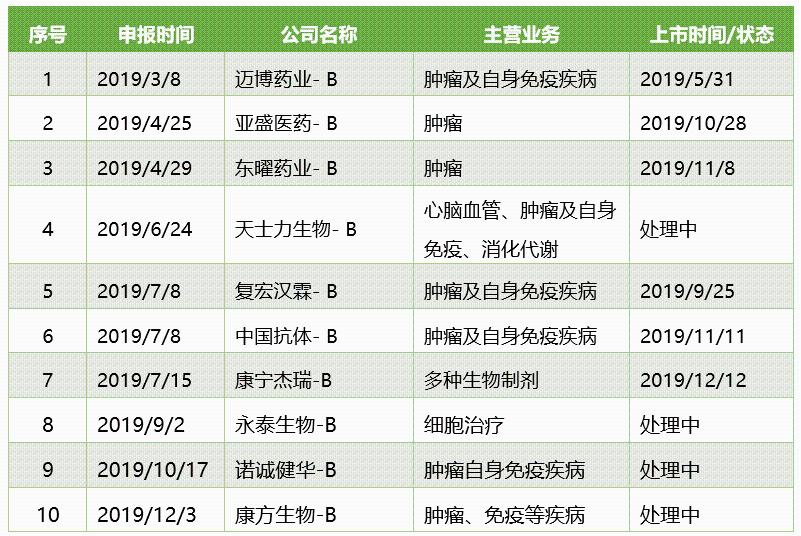
其中,康寧傑瑞計劃在12月12日上市,募資15~17億港元;康方生物12月3日晚間披露了赴港上市的招股書,Pre-IPO估值8.36億美元。另據知情人士透露,另一家“雙抗”公司岸邁生物也正在籌劃登陸二級市場的相關工作。
技術日趨成熟
雙特異性抗體(簡稱“雙抗”)能識別並特異性結合兩個抗原或表位,從而能夠同時阻斷兩種抗原/表位介導的生物學功能,並有望誘導出以前單克隆抗體無法獲得的潛在的優越生物學效應。
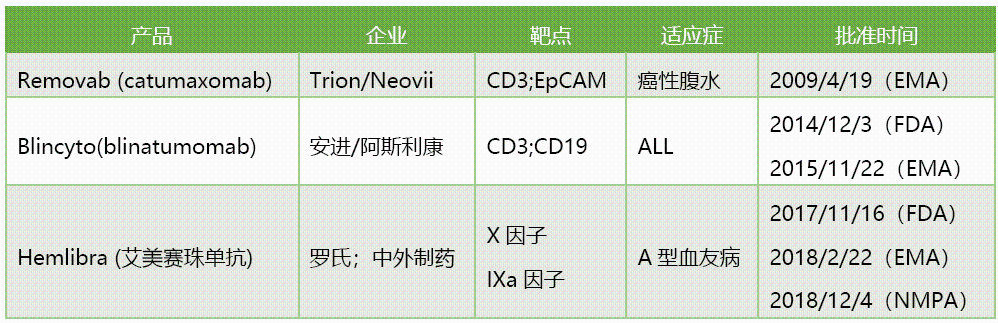
目前已經獲批上市的雙抗藥物
來源:醫藥魔方NextPharma
2009年4月20日歐盟批准的Removab(catumaxomab)是全球首個上市的雙特異性抗體藥物。這是一種新的治療方法,獲批時間還早於全球首個上市的腫瘤免疫抗體藥物Yervoy(2011年3月獲得FDA批准)。
在此後的10多年時間裏,腫瘤免疫治療(I-O)領域發生了“翻天覆地”的變化,與I-O相關的研究呈指數增長,僅PD-1/PD-L1靶點相關的臨牀試驗就多達數千個。隨着單一腫瘤免疫治療藥物侷限性的逐漸凸顯,聯合療法的開發成為大勢所趨,以PD1/PD-L1為靶點之一的雙抗設計思路也日益多見。
截止到2019/12/4,醫藥魔方全球新藥數據庫NextPharma共收錄雙特異性抗體項目233個。
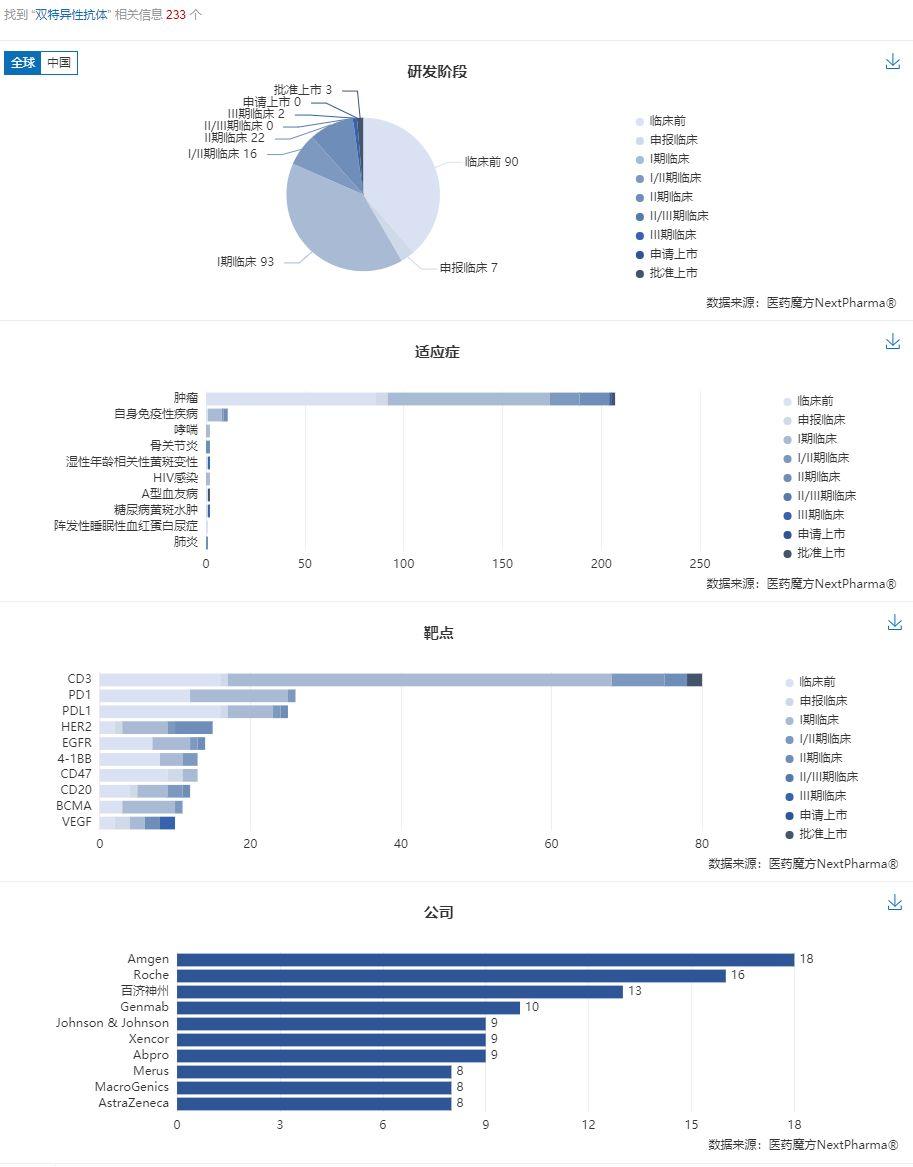
來源:醫藥魔方NextPharma
根據可視化分析結果可以發現,擬開發適應症絕大部分以腫瘤為主(206),其次是自身免疫疾病(10);靶點主要集中在CD3(80個)、PD1/PD-L1(51個)、HER2、EGFR、4-1BB上面。開發階段以臨牀前~I期的早期階段居多(190個),佔81.5%;
“雙特異性抗體涉到靶點生物學、結構生物學、抗體工程、篩選策略,早期雙特異性抗體表達困難,穩定性差,生產工藝複雜;且早期研發成本明顯高於單克隆抗體。”雙特異性抗體領域的開拓者、岸邁生物創始人兼CEO吳辰冰博士此前在接受記者採訪時曾表示,“如今這些技術難點基本被業界攻破,國內外已經有多家藥企形成了具有國際知識產權的雙抗平台。”
市場格局逐步打開
除了潛在的成本效益、臨牀試驗的簡單性以及在聯合治療中可簡易使用之外,具有免疫腫瘤靶點的雙特異性抗體亦可以根據所選靶點和設定結構而取得額外的生物效益。
最近康方生物、康寧傑瑞等多家制藥公司公佈的雙特異性抗體的早期臨牀數據也進一步激發市場對發展雙特異性抗體免疫腫瘤治療的興趣。
迄今為止,FDA共批准2種雙特異性抗體,其中只有一種是免疫腫瘤療法,即針對CD3/CD19靶點的Blincyto(blinatumomab)。我國的藥品審評審批機構CDE也於2019/10/29受理了blinatumomab上市申請,有望在明年獲得監管部門批准上市。
此外,多家跨國藥企已經部署了大量資源用於開發雙特異性抗體,尤其是基於已獲批准的免疫檢查點的雙特異性抗體。2014年,MacroGenics憑藉其強大的技術平台與Janssen和Takeda等多家制藥企業建立了戰略合作伙伴關係。
2015年1月,GSK與Adimab達成戰略合作,共同開發雙特異性抗體。同年,禮來公司與信達簽署了關於3種針對PD-1的雙特異性抗體的開發和商業應用的協議。
到了2019年,這樣的合作更是應接不暇。比如:今年2月,德國默克與GSK就宣佈達成全球戰略合作聯盟,以37億歐元的協議聯合開發靶向PD-L1/TGF-β的雙功能融合蛋白類腫瘤免疫療法M7824;5月,基石藥業宣佈從瑞士Numab公司引進單價三特異性抗體片段分子ND021在大中華區、韓國和新加坡的獨家開發和商業化權利;11月,來自賽諾菲的科學家們在開發用於癌症免疫治療的三特異性抗體方面取得了新的突破。
之前全球首個獲批上市的雙特異性抗體catumaxomab由於商業不成功,最終於2017年宣佈退市、停產。目前,2款在售的雙特異性抗體藥物在市場表現方面可以説平分秋色。2018年,blinatumomab的全球銷售額為2.3億美元,emicizumab的全球銷售額為2.34億瑞士法郎。雙特異性抗體的市場正在逐步被打開。
據康方生物招股書披露,PD-(L)1/CTLA-4雙特異性抗體的潛在可治療患者羣體包括對PD-(L)1單一療法、CTLA-4單一療法或兩者的組合療法有反應的癌症患者,包括對過往治療有反應但又復發的患者(該類患者佔實體瘤患者約67%),且同時可能對於對PD-(L)1單一療法沒有明顯反應的癌症患者有效。
兩家擬上市雙抗公司看點
康寧傑瑞和康方生物是國內上市進程最快的兩家雙抗企業,二者也都屬於技術實力比較強的公司,都曾將技術項目轉讓給大企業。
康寧傑瑞創立10年有餘,員工從1名擴展到近400名(上市公司主體員工220人),僅進行了2輪融資。也就是説,過去的八九年時間裏,康寧傑瑞是靠着自身的研發能力,以將項目轉讓授權的方式來自我造血。比如其將重組人凝血VIII因子項目轉讓給正大天晴。
康方生物亦是如此。早在是2015年,康方生物就以2億美元向製藥巨頭默沙東授權許可了創新單抗藥物開發權益,是中國第一個創新型生物科技公司將完全自主研發的腫瘤免疫單抗新藥授權給海外製藥巨頭,具有里程碑意義;今年6月,正大天晴又看上了康方生物開發的PD-1項目,並決定與其成立合資公司共同開發,這種老牌藥企青睞“小鮮肉”的合作在中國製藥產業史上也屬於罕見。
此次赴港上市,康寧傑瑞的資產組合包括1款PD-LI、1款融合蛋白和6款雙特異性抗體;而其餘的資產全部打包進了非上市公司“蘇州康寧傑瑞”。康方生物則是整體上市,管線更為豐富,靶點涉及也更為廣泛,包括PD-1/L1、CTLA-4、CD47、PCSK9、VEGF等熱門靶點。
江蘇康寧傑瑞產品管線
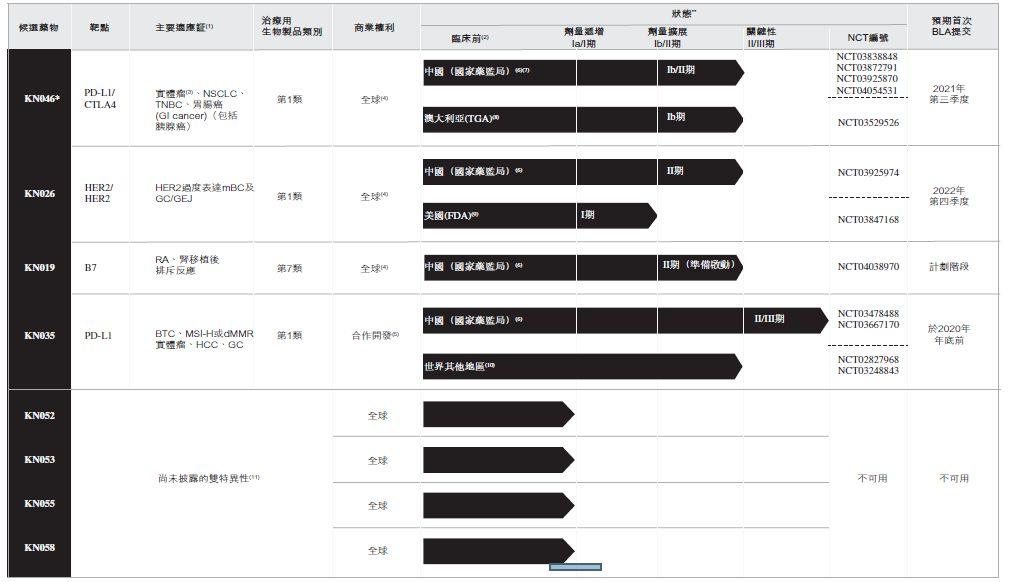
來源:康寧傑瑞招股書
康方生物產品管線
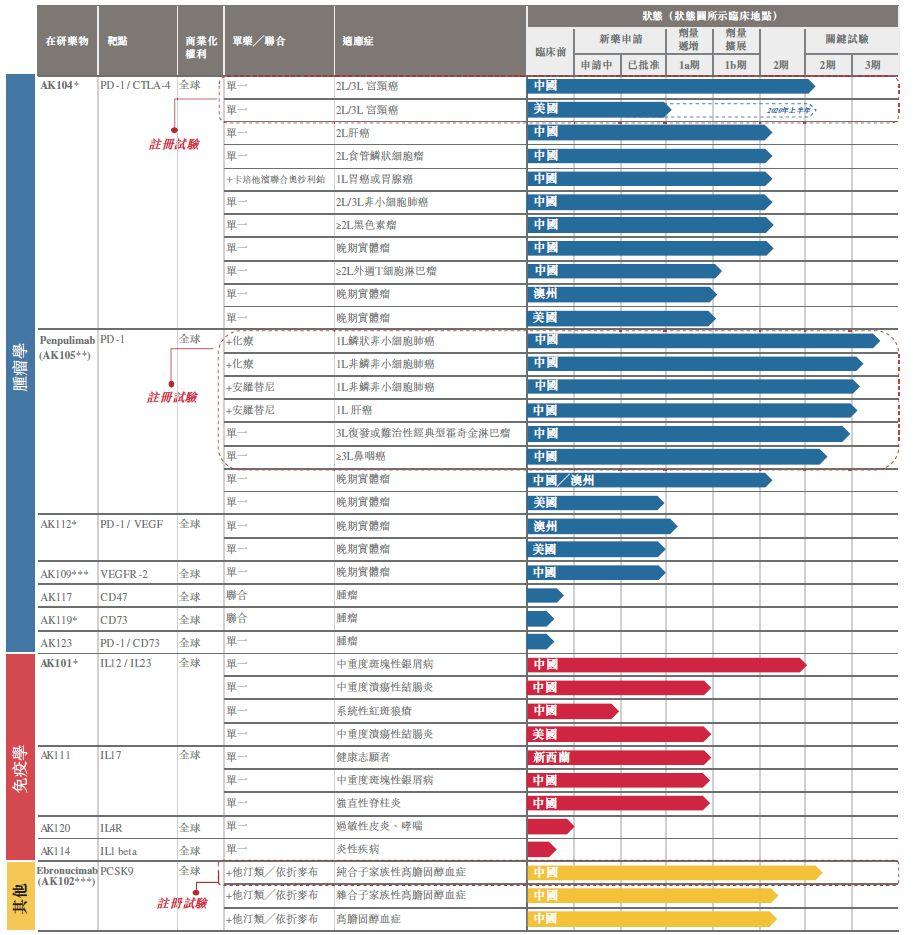
來源:康方生物招股書
康方生物的項目靶點非常豐富跟其創始團隊背景也有很大關係。其核心團隊多位科學家來自CRO中美冠科公司。比如其創始人兼CEO夏瑜博士在中美冠科的4年時間裏,構建了中美冠科生物技術的平台,同時負責組建團隊、制訂及執行戰略的決策職責。其首席科學官李百勇博士此前就職於美國輝瑞,負責領導一系列癌症免疫療法新藥項目的藥物發現工作。其共同創始人張鵬博士、王忠民博士皆曾在中美冠科工作並擔任高管。
此次上市募資,康寧傑瑞和康方生物對於資金主要用途的規劃都是用於雙特異性抗體項目的開發。
康寧傑瑞進展最快的“雙抗”品種是KN026(HER2/HER2)和KN046(PD-L1/CTLA-4),康寧傑瑞此次所募資金的50%是用於其核心產品KN046的研發及商業化,20%用於將用於KN026的研發及商業化。
康方生物進展較快的是AK104(PD-1/CTLA-4)、AK101(IL12/IL13)和AK112(PD-1/VEGF),康方生物計劃此次所募資金的30%用於AK104的臨牀試驗,10%用於AK101的臨牀試驗,10%用於AK111和AK112的臨牀試驗。
結語
大家都知道,醫藥行業,最受歡迎的企業名字是“瑞”字輩,比如輝瑞、恆瑞、博瑞……;排在第二位的非“康”字輩莫屬了,比如康弘藥業、康希諾、康方生物、康寧傑瑞……。一個“康”字,也表達了企業家在創立公司時的初心,即“以造福大眾健康為本”。
雙特異性抗體技術在中國從興起到被投資者認可,時間並不長。未來是否會有更多的“雙抗”翹楚湧現呢?


