機構:國泰君安
評級:增持
本報告導讀:
公司公告抗 PD-1 單抗派安普利上市申請獲藥監局受理,申報適應症為復發或難治性經典型霍奇金淋巴瘤,公司產品線不斷創新升級,維持增持評級。
摘要:
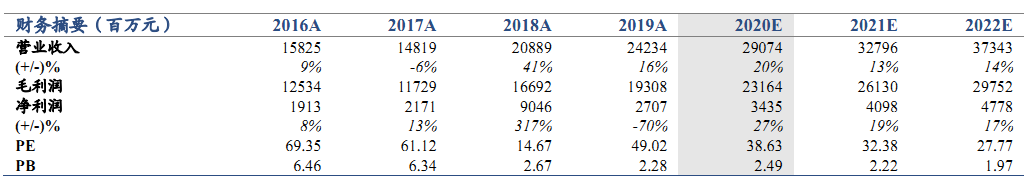
維持“增持”評級。公司2020 年5月26日發佈公告,其與康方生物共同開發及商業化的抗PD-1單抗藥物安尼可(通用名:派安普利,研發代號: AK105)的新藥上市申請,已獲中國國家藥品監督管理局受理,用於治療復發或難治性經典型霍奇金淋巴瘤患者。我們維持公司2020-2022年EPS預測值0.27/0.33/0.38元,考慮到公司大品種研發成果不斷落地,產品線不斷創新升級,上調目標價至13.80 港元(原為 12.13港元),維持增持評級。
派安普利可能是第5個上市的國產 PD-1抑制劑,有望藉助公司強大銷售網絡快速放量。截止2020年5月,我國PD-(L)1產品已體現出進口和國產4+4的局面,從上市申報適應症來看,派安普利延續了國產 PD-1用小適應症快速獲批上市的策略。國產和進口PD-1由於定價不同,搶佔的是不同消費層級的患者,派安普利未來的上市,更多對現有的國產PD-1產品有衝擊。我們預計卡瑞利珠單抗在 2019年上市5個月銷量突破10億,(對比信達和君實的 PD-1產品已在 2018年底獲批,而2019年全年銷售額分別為 10.2億、 7.8億),可以看出, PD-1的推廣與企業醫院終端覆蓋面、銷售體系等商業化綜合能力休慼相關。未來派安普利上市,有望憑藉公司 3000多人的腫瘤銷售網絡快速放量。
商業化策略逐漸清晰:以小適應症快速上市,大適應症的臨牀加快跟進。截止 2020 年 5 月 16 日,派安普利共有 13 項臨牀正在進行,其中 9項試驗同時在中美進行了申報。目前已經進入三期階段的有肺癌一線、胃癌二線和晚期肝細胞癌 3項患者基數較大的適應症,其中胃癌和肝癌的用藥方式皆為派安普利與安羅替尼聯用,“強強組合銷售+大適應症策略”的發展態勢已初見端倪。
催化劑:新產品及新適應症的研發進展,光腳品種的放量。
風險提示:帶量採購的風險;新藥研發的不確定性風險。